Oksijen, periyodik tabloda 2. periyotta 16. grupta bulunan, kimyasal sembolü “O” ve atom numarası 8 olan bir kimyasal elementtir. Bir ametal olan oksijen, evrende kütle bakımından en bol bulunan ( hidrojen ve helyumdan sonra ) üçüncü, Dünya kabuğunda kütle bakımından en bol bulunan ve insan vücudunda kütle bakımından en çok bulunan elementtir. Adını Yunanca “oxys + genes”, yani “asit oluşturucu” kelimelerinden alan oksijen, 1772’de Scheele ve bağımsız olarak 1774’te Priestly tarafından keşfedilmiştir. Oksijene adını Fransız bilim insanı Antoine Lavoisier vermiştir.
Karbon, kükürt, oksijen, kalay ve fosfor dahil olmak üzere birçok element allotropi özelliği gösterir. Örneğin karbon allotropları arasında elmas, grafit, grafen ve fullerenler bulunur. Allotropi (Yunanca allos, “diğer” ve tropos, “tarz” veya “biçim”), bazı kimyasal elementlerin iki veya daha fazla farklı formda var olma özelliğidir. Her allotropta, elementteki atomların birbirine bağlanma şekilleri, yapısal dizilimleri farklıdır. Dolayısıyla allotroplar, bir elementin farklı yapısal modifikasyonlarıdır. Allotroplar, bir halin her koşulda kararlı olduğu monotropik veya farklı hallerin farklı koşullarda kararlı olduğu enantiyotropik olabilir. Oksijenin en iyi bilinen ve farklı moleküler formüllere sahip olan iki allotropu bulunmaktadır, bunlar dioksijen (O2) ve ozon (O3)’dur, katı, sıvı ve gaz hallerinde var olabilirler. Dioksijen, en yaygın oksijen formudur. Canlı organizmaların solunumları için son derece önemli bir gazdır. İki oksijen atomu arasında çift bağ bulunur. Ozon (O3), üç oksijen atomundan oluşan triatomik bir moleküldür. İki atomlu (diatomik) O2’den (oksijen gazından) çok daha az kararlı olan bir oksijen allotropudur. Aşağıda bu iki allotrop hakkında daha fazla bilgi yer almaktadır.
Dioksijen
Dioksijen, kimyasal formülü O2 olan oksijenin en yaygın bulunan allotropudur. Doğada Oksijen çoğunlukla yalnızca bu formda bulunur. Dioksijenin bağ uzunluğu 121 pm ve bağ enerjisi 498 kJ/mol’dür. Molekül ağırlığı 32 g mol -1’dir. Renksiz, kokusuz ve tatsız bir gazdır. Fotosentetik mikroorganizmalar oksijeni serbest bırakana kadar Dünya’nın ilk zamanlarında çok az oksijen olduğu söylenebilir. Serbest diatomik oksijen veya dioksijen, günümüzde azotla birlikte havanın iki ana bileşeninden biridir ve havanın hacminin yaklaşık beşte birini (%21’ini ) oluşturur. Suda çok az çözünür ve havadan biraz daha ağırdır. Oksijenin manyetik özellikleri de vardır.
Oksijen gazı -182,95 santigrat derecede yoğunlaştığında mavimsi renkli bir sıvıya dönüşür, -218,79 santigrat derece sıcaklıkta donar. Bu gaz oldukça reaktiftir, inert gazlar hariç tüm elementlerle reaksiyona girerek oksitler oluşturur. Bu nedenle iyi bir oksitleyicidir. Yanmayı destekler ve ekosistemler için hayati önem taşır. Dioksijen, fotosentez sırasında siyanobakteriler, algler ve bitkiler tarafından sudan üretilir (oksijen üreten bitkiler solunum yaparak oksijen de tüketir)ve aerobik solunum yapan organizmalarda yaşamı sürdürmek için gereken enerji, oksijen içeren bileşikler olan şekerlerin ve karboksilik asitlerin enzim aracılı oksidasyonu ile sağlanır. Oksijen olmadan, aerobik solunum yapan çoğu organizma dakikalar içinde ölür, ancak, serbest oksijen zorunlu anaerobik organizmalar için toksiktir. Bu gaz hastanelerde, kaynak işlerinde ve diğer birçok endüstride kullanılır.
Ozon
Triatomik oksijen yani Ozon,( O3 ) , oksijenin daha az yaygın olan 3 oksijen atomlu allotropudur. Kendine özgü bir kokuya sahip zehirli bir gazdır. 1840 yılında Christian Friedrich Schönbein, şimşek fırtınalarındaki tuhaf kokudan dolayı Yunanca koku anlamına gelen “ozo” kelimesinden esinlenerek”ozon” adı verilmiştir. Şimşek çakmasından kaynaklanan koku, ozonun kendisinden değil, hızlı kimyasal değişimler sırasında üretilen iyonlardan kaynaklanır. Elektrik motorlarından, lazer yazıcılardan ve fotokopi makinelerinden gelen keskin, klor benzeri bir koku olarak izleri tespit edilebilir. Kauçuk, kumaş vb. gibi malzemelere zarar veren ozon kauçuk fabrikalarından gelen klor benzeri bir koku olarak algılanabilir. Ozon -112 santigrat derecede (kaynama noktası) sıvılaşır, -193 derece santigratın altındaki sıcaklıklarda ise mor-siyah bir katı oluşturur. Sıvı ve katı ozon, sıradan oksijenden daha koyu mavi bir renge sahiptir fakat genellikle gazda veya suda o kadar düşük konsantrasyonlarda bulunur ki rengi görünmez. Çözünmüş ozon seviyesi arttıkça suyun rengi koyulaşır. Sudaki mavi renk, 50 ppm’nin üzerinde gözle görülür şekilde belirginleşmeye başlar. Ozonun mavi rengi, bu 1 galonluk su sürahisi gibi daha büyük kaplarda daha belirgindir. Ozon, polar olmayan çözücülerde daha çözünür, suda ise daha az çözünür. Ozonun oksidasyon kabiliyeti oksijenden daha yüksektir. Yüksek konsantrasyonlarda kararsızdır ve atmosferik koşullarda yaklaşık yarım saatte sıradan diatomik oksijene dönüşür.
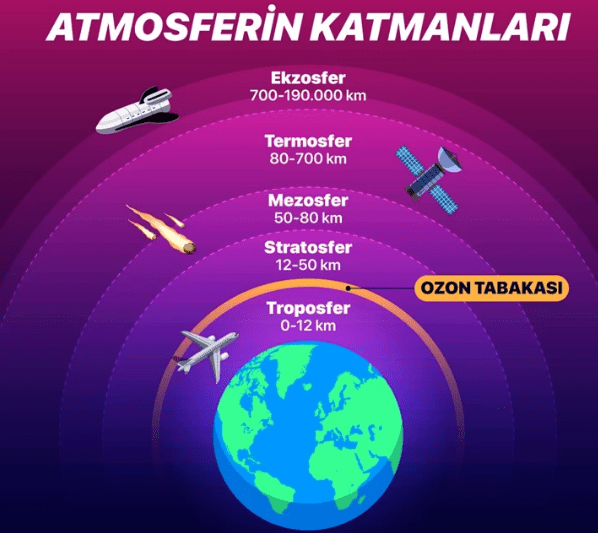
Troposferik Ozon
Troposfer, atmosferin en alt tabakasıdır. Yer seviyesinden başlayarak deniz seviyesinden yaklaşık 10 km yukarıya kadar uzanır. Düşük seviyeli ozon (kötü ozon veya troposferik ozon), Dünya Sağlık Örgütü tarafından bir kirletici olarak kabul edilmektedir. Doğrudan araba motorları veya endüstriyel faaliyetler tarafından yayılmaz. Güneş ışığının, kirliliğin kaynağında veya rüzgarın etkisiyle kilometrelerce uzakta, hidrokarbonlar ve nitrojen oksitler içeren havayla reaksiyona girmesiyle oluşur. Ozon, aldehitler gibi bazı hidrokarbonlarla doğrudan reaksiyona girerek havadan uzaklaştırılmalarını başlatır, ancak bu ürünler dumanın temel bileşenleridir. UV ışığıyla ozonun fotolizi, hidroksil radikalinin üretimine yol açar ve bu, havadan hidrokarbonların uzaklaştırılmasında rol oynar, ancak aynı zamanda güçlü göz tahriş edicileri olabilen peroksiasil nitratlar gibi duman bileşenlerinin oluşumunun ilk adımıdır. Çoğu insan havada yaklaşık 0,015 ppm (milyonda 1 birim)’yi tespit edebilir. 0,1 ila 1 ppm’ye maruz kalmak ( 8 saatten fazla maruziyet) baş ağrısına, gözlerde yanmaya ve solunum yollarında tahrişe neden olur. Gök gürültülü fırtınaların neden olduğu artan ozon ile astım hastalarının hastaneye yatışları arasında bir bağlantı olduğu gösterilmiştir. Dünya Sağlık Örgütü’nün hava kalitesi yönergeleri gibi yönergeler, hangi seviyelerin ölçülebilir sağlık etkilerine neden olabileceğine dair ayrıntılı çalışmalara dayanmaktadır. Troposferik ozonun atmosferik ömrü yaklaşık 22 gündür. İnsan sağlığı üzerinde bir etkiye sahip olmasının yanı sıra fotosentezi engelleyen ve bazı bitki türlerinin genel büyümesini engelleyen yer seviyesindeki ozon ve kirliliğin artması nedeniyle tarımsal verimde önemli bir azalma olduğuna dair kanıtlar da bulunmaktadır.
Stratosferik Ozon
Troposferin üzerinde, troposferin tepesinden yerden yaklaşık 50 km yüksekliğe kadar uzanan stratosfer bulunur. Atmosferdeki en yüksek ozon seviyeleri, yüzeyden yaklaşık 10 km ila 50 km yukarıda, ozon tabakası olarak da bilinen stratosferde bulunmaktadır. Stratosferdeki ozon (iyi ozon) çoğunlukla ultraviyole ışınlarının O2’yi (dioksijeni) parçalamasıyla oluşan atomik oksijen ile O2’nin reaksiyonu sonucu ( O2 > O + O2 > O3) doğal olarak oluşur. Burada, Güneş’ten gelen ve çoğu yaşam formu için büyük dozlarda zararlı olabilecek, UV ışınları olarak da adlandırılan daha kısa dalga boylarını (320 nm’den az: 270 ila 400 nm) filtreler (emer), ısıya dönüştürür, yeryüzüne ulaşmasını engeller. Bu nedenle, troposferin aksine, stratosfer yükseldikçe ısınır. Aynı dalga boyları, insan sağlığı için gerekli olan D vitamini üretiminden de sorumludur. Ozon ayrıca dioksijen varlığında elektrostatik deşarj ile de oluşur. Son yıllarda stratosferdeki ozon miktarı, çoğunlukla CFC’ler ve benzeri klorlu ve bromlu organik moleküllerin emisyonları nedeniyle azalmaktadır. Bu emisyonlar, ozon tabakasını incelten katalizörlerin konsantrasyonunu doğal ortamın üzerine çıkarmıştır. Ozon, atmosferin yalnızca %0,00006’sını oluşturur. Ozonun ağaç büyümesi üzerinde asit yağmuru kadar ciddi olumsuz bir etkiye sahip olduğu ileri sürülmüştür.
Ozon ve Sağlık
Süperoksit , singlet (tekli) oksijen, hidrojen peroksit ve hipoklorit iyonları gibi reaktif oksijen formlarıyla birlikte, yabancı cisimleri yok etmek amacıyla doğal olarak beyaz kan hücreleri ve diğer biyolojik sistemler (kadife çiçeği kökleri gibi) tarafından ozon üretilir. Ozon, organik çift bağlarla doğrudan reaksiyona girer. Ayrıca, ozon dioksijene parçalandığında, oldukça reaktif olan ve birçok organik moleküle zarar verebilen oksijensiz radikallerin oluşumuna yol açar. Ozonun kan dolaşımındaki kolesterolü plağa dönüştürdüğü (bu, atardamarların sertleşmesine ve daralmasına neden olur) bulunmuştur. Dahası, ozonun güçlü oksitleyici özelliklerinin iltihaplanmaya katkıda bulunan bir faktör olabileceğine inanılmaktadır. Ozonun vücutta nasıl oluşturulduğu ve ne yaptığı konusundaki neden-sonuç ilişkisi hala değerlendirme altında olup, diğer vücut kimyasal süreçleri de aynı reaksiyonların bazılarını tetikleyebildiğinden, hala çeşitli yorumlara tabidir.
Ozon Tedavisi
Ozon tedavisi, birçok farklı ülkede alternatif tıpta tıbbi tedavi olarak kullanılmıştır ancak, kullanımı tartışmalıdır. Amerika Birleşik Devletleri Gıda ve İlaç Dairesi (FDA), ozonun toksisitesi ve toksik olmayan seviyelerde herhangi bir faydalı etkiye dair bilimsel kanıt bulunmaması nedeniyle ozon jeneratörlerinin veya ozon gazının herhangi bir tıbbi rahatsızlığın tedavisi için pazarlanmasını yasaklamıştır. Kenneth R. Thiefault ve Mardel Barber adlı bir çift, AIDS, kanser, uçuk, hepatit, kangren veya “neredeyse her türlü hastalığı” tedavi etmek için ozon jeneratörlerinin pazarlanması ve FDA’ya herhangi bir etkinlik veya güvenlik kanıtı sunulmaması nedeniyle 1999 yılında bu yasağı ihlal ettikleri gerekçesiyle suçlu bulunup hapse atılmışlardır. Ancak, FDA’nın, cihaz ve tedavi sıkı testlerden geçmediği sürece hiçbir cihazın tıbbi bir durumu tedavi ettiğini iddia etmesine izin veremeyeceğini belirtmekte fayda vardır. ABD’de tıbbi sınıf ozon cihazları satmak yasa dışı olmadığı gibi, bir cihaza sahip olmak veya kullanmak da yasa dışı değildir. Yasa dışı olan, bir hastalığı tedavi ettiğini iddia ederek satmaktır. FDA ve sağlık kuruluşları nezdinde tanınmayan statüsüne rağmen, ABD’de birçok kişi ozon tedavisini kullanmaktadır. ABD’de tıbbi sınıf bir ozon cihazı satmak veya sahip olmak yasaldır. Ayrıca kişinin kendisine ozon uygulaması da yasaldır. Uygulayıcıların ozon uygulayıp uygulayamayacağı veya kullanımını tavsiye edip edemeyeceği daha karmaşık bir konudur.
Ozonun Endüstriyel Uygulamaları
Ozonun birçok endüstriyel ve tüketici uygulaması vardır. Günümüzde ozonun endüstriyel bir kimyasal olarak kullanımı bir miktar sınırlıdır. Ozonun en büyük kullanım alanı farmasötiklerin , sentetik yağlayıcıların ve diğer birçok ticari olarak faydalı organik bileşiğin hazırlanmasıdır; burada karbon – karbon bağlarını koparmak için kullanılır. Ayrıca maddelerin ağartılmasında ve hava ve su kaynaklarındaki mikroorganizmaların öldürülmesinde de kullanılabilir. Birçok belediye içme suyu sistemi, daha yaygın olan klor yerine ozonla bakterileri öldürür. Yüzey suyu arıtma tesislerinde Giardia ve Cryptosporidium gibi su kaynaklı parazitleri yok etmek için kullanılır. Bu işleme ozonlama denir. Ozonun oksidasyon potansiyeli çok yüksektir. Ozon organoklor bileşikleri oluşturmaz ve arıtmadan sonra suda kalmaz, bu nedenle bazı sistemler borularda bakteri büyümesini önlemek için az miktarda klor verir veya periyodik testlerin sonuçlarına göre aralıklı olarak klor kullanabilir. Elektrik enerjisinin bol olduğu yerlerde ozon, talep üzerine üretildiği ve tehlikeli kimyasalların taşınmasını ve depolanmasını gerektirmediği için suyun arıtılmasında uygun maliyetli bir yöntemdir.
ABD ve dünya genelindeki birçok hastane, ameliyatlar arasında ameliyathaneleri dezenfekte etmek için büyük ozon jeneratörleri kullanmaktadır. Odalar temizlenir ve ardından hava geçirmez şekilde kapatılır, ardından kalan tüm bakterileri etkili bir şekilde öldüren veya etkisiz hale getiren ozonla doldurulur. Bazıları iyonizasyon kullanan yüksek düzeyde ozon üreten cihazlar, üzerinde oturulmayan binaları, odaları, hava kanallarını ya da kanal sistemlerini, odunlukları, tekneleri ve diğer araçları dezenfekte (sterilize) etmek ve koku gidermek için kullanılır.
Ozon duman veya sis oluşumuna katkıda bulunduğundan, çoğu ülke popüler “iyonlaştırıcı” cihazlar tarafından üretilebilecek ozon miktarını düzenlemektedir. Ev kullanımına yönelik küçük ozon makineleri, endüstriyel muadillerine göre çok daha az ozon üretir. Kişisel kullanım için tasarlanmış neredeyse tüm ozon jeneratörleri, daha düşük maliyeti nedeniyle korona deşarj yöntemini kullanır. Düşük seviyelerdeki ozonun konutlarda bir miktar dezenfektan olarak kullanılabileceği reklamlarda belirtilse de, havadaki patojenler üzerinde önemli bir etki yaratmak için gereken ozon konsantrasyonu, ABD İş Sağlığı ve Güvenliği İdaresi ile Çevre Koruma Ajansı tarafından önerilen güvenli seviyelerin çok üzerindedir. Bazı ülkelerde ozon üreten cihazların üretimi veya kullanımı yasaktır.
Oksijenin Diğer Allotropik Formları
Dioksijen (O2 gazı) ve ozon (O3)’dan başka oksijenin birkaç allotropu daha vardır. Bunlar atomik oksijen, tekli (singlet) oksijen, tetraoksijen (O4) ve katı oksijendir.
Atomik oksijen (O1)
Daha doğru bir şekilde O(3P) olarak gösterilir. Serbest radikaldir. Bu allotrop, tekli oksijen atomlarının yakındaki moleküllerle hızlı bir şekilde bağlanma eğiliminde olması nedeniyle çok reaktiftir. Dünya yüzeyinde çok uzun süre doğal olarak varlığını sürdüremez.
Tekli (Singlet) oksijen
Tekli oksijen(1O2), moleküler oksijenin iki metastabil halinden biridir. Moleküler oksijenin elektronik olarak uyarılmış, moleküler oksijenden daha az kararlı hali için kullanılan yaygın isimdir ve yaygın organik moleküllere karşı çok daha reaktiftir. Doğada tekli oksijen, genellikle güneş ışığının enerjisi kullanılarak fotosentez sırasında sudan oluşur. Ayrıca troposferde kısa dalga boylu ışık tarafından ozonun fotolizi ile ve bağışıklık sistemi tarafından aktif oksijen kaynağı olarak üretilir. Fotosentetik organizmalardaki (ve muhtemelen hayvanlardaki) karotenoidler, singlet oksijenden enerjinin emilmesinde ve dokulara zarar vermeden önce uyarılmamış temel duruma dönüştürülmesinde önemli bir rol oynar.
Tetraoksijen (O4)
Tetraoksijen (O4), oksozon olarak da bilinir, geçici bir moleküler yapıda bağlı dört oksijen atomundan oluşan nadir ve metastabil bir oksijen allotropudur. İlk olarak 1924’te Gilbert N. Lewis tarafından sıvı oksijenin anormal manyetik duyarlılığını açıklamak için teorik olarak önerilmiş ve ilişkili O2 dimerlerinin varlığını öne sürmüştür. 1999 yılında, araştırmacılar kırmızı oksijen olarak da bilinen epsilon fazındaki (10 GPa’nın üzerindeki basınçlarda)katı oksijenin tetraoksijen (O4) olduğunu düşünmüşlerdir. Ancak 2006 yılında, X-ışını kristalografisi ile bu kararlı fazın aslında O4 değil O8 (oktaoksijen ) olduğu gösterilmiştir. Tetraoksijen, 2001’de gaz fazında nötralizasyon-reiyonizasyon kütle spektrometrisi ile deneysel olarak tespit edilmiştir. O4’ün, dispersiyon ya da dağılma kuvvetleri tarafından bir arada tutulan iki halter şeklindeki O2 molekülünden oluşması mümkündür. Lewis’in öngörüsünden bu yana teorik ilgi görmesine rağmen, tetraoksijen oldukça kararsız ve manyetik olmayan bir yapıdadır ve kararlı, paramagnetik diatomik oksijen (O2) ile keskin bir tezat oluşturmaktadır. Tetraoksijen, soluk mavi bir gaz olarak tanımlanmıştır, ancak hızlı bir şekilde O2’ye ayrışması nedeniyle toplu miktarlarda izole edilmemiş veya standart koşullar altında gözlemlenmemiştir. Tetraoksijen (O4) toksik değildir, sıvı halde yaklaşık +43 santigrat derece sıcaklığa kadar kararlıdır ve iki kat moleküler ağırlığı nedeniyle sıvı oksijenin iki katı yoğunluğa sahiptir. Molekülünün iki oksijen (O2) molekülüne termal ayrışma sıcaklığı yaklaşık +200 santigrat derecedir. Sıvı tetraoksijen, 2.15 g/cm3 yoğunluğa sahip açık leylak rengindedir. Tetraoksijen suda çözünmez ve hareketli-sıvı viskoziteye sahiptir.
Tetraoksijenin ayırt edici özelliklerinden biri, oldukça yüksek oluşum enerjisidir (Gibbs standart enerjisi Delta H: 217 kJ/mol veya 3.391 KJ/kg). Bu enerji, oluşumları sırasında O4 moleküllerinde depolanır ve O4 moleküllerinin ayrışması anında, yani roket yakıtının yanması sırasında serbest bırakılır. Tetraoksijen, metalurji, kimya ve diğer birçok endüstride roket yakıtı oksitleyicisi olarak oksijen yerine doğrudan kullanılabilir. Bir oksitleyici madde olarak tetraoksijen, tam olarak oksijen gibi davranarak tam olarak aynı bileşikleri oluşturur. Sıvı oksijenin yaklaşık iki katı olan daha yüksek yoğunluğu, daha küçük oksitleyici tanklarına olanak sağlayarak aracın toplam kütlesini azaltabilir ve yük kapasitesini artırabilir. O4’ün roket yakıtı oksitleyici olarak kullanılması, geleneksel kriyojenik yakıt kombinasyonlarının tüm avantajlarını kriyojenik olmayan bir ortamda birleştirmenin yanı sıra, özgül itkiyi, itkiyi, fırlatmaya hazır olma durumunu ve personel güvenliğini önemli ölçüde artırır.
Katı Oksijen
Katı oksijenin altı farklı fazının var olduğu bilinmektedir:
1-Alfa-fazı: Katı oksijenin soluk mavi renkte ve antiferromanyetik olan alfa fazı monoklinik bir kristal yapı sergiler, paralel dimerlerin katmanlı tabakalar oluşturduğu bir balıksırtı düzenlemesiyle karakterize edilir. 1 atm’de, 23,8 K’nin (-249,35 santigrat) altındaki sıcaklıklarda oluşur. En düşük enerjili konfigürasyonu temsil eder.
2-Beta-fazı: Soluk mavi ila pembe renkte görünür. 1 atm basınçta, 43,8 K’nin (-229,35 santigrat) altında oluşur, rombohedral kristal yapıdadır. Oda sıcaklığında ve yüksek basınçta tetraoksijene dönüşüm başlar.
3-Gamma-fazı: Soluk mavi görünür. 1 atm’de, 54,4 K’nin ( -218,75 santigrat) altında oluşur, kübik kristal yapıya sahiptir. Bu faz, O2 moleküllerinin önemli yönelimsel bozukluk gösterdiği ve onu daha düzenli düşük sıcaklık fazlarından ayıran plastik bir kristal durumunu temsil eder.
4-Delta-fazı: Turuncu renklidir. Oda sıcaklığında 9 GPa (gigapaskal) basınçta oluşur. Ortorombik polimorf yapıdadır.
5-Epsilon-fazı: Katı oksijenin epsilon fazının rengi koyu kırmızıdan siyaha kadardır. Ortam basıncında yaklaşık 70 K’nin(-203,15 santigrat) üzerinde veya oda sıcaklığında 10 GPa’dan yüksek basınçlarda(10–96 GPa basınç aralığında) oluşur. Moleküler düzenlemeden etkilenen elektronik geçişler nedeniyle kırmızı bir renk (kararlı oktaoksijen fazı) gösterir. En iyi bilinen katı oksijenlerden biri olan oktaoksijen O2’nin farklı bir kristal fazı değil, sekiz oksijen atomundan oluşan bir oksijen allotropudur. Oktaoksijen (O8), aynı zamanda kırmızı oksijen olarak da bilinir. Kırmızı renk, basınç arttıkça daha da koyulaşarak siyaha dönüşür, yaklaşık 40 GPa’da görünür ışığa neredeyse opak hale gelir. Sıkıştırmanın basit bir molekülün elektronik durumlarını nasıl bozabileceğinin açık bir örneği olan bu renk değişimi, katı oksijenin bir özelliğidir ve diğer hafif homonükleer diatomik moleküler katılarda görülmez.
6-Zeta-fazı: Metalik oksijendir. Katı oksijen 96 GPa’dan daha büyük basınçlarda diatomik moleküler yapıyı koruyan bir metale, zeta fazına dönüşür. Bu faz, 1990 yılında oksijenin 132 GPa’ya basınçlandırılmasıyla keşfedilmiştir. Metalik küme içeren zeta fazı 100 GPa’nın üzerindeki basınçlarda ve 0,6 K’nin (-272,55 Santigrat) altındaki bir sıcaklıkta süperiletken hale gelir.
Özet
Oksijen gazı ve ozon, bir kimyasal element olan oksijenin iki ana gaz bileşiğidir. Oksijen gazı ile ozon arasındaki temel fark, oksijenin iki atomlu bir oksijen elementi molekülü, ozonun ise üç atomlu bir oksijen molekülü olmasıdır. Farklı kimyasal ve fiziksel özelliklere sahiptirler. Birbirlerinden çok farklıdırlar ve günlük hayatta ve çevrede farklı roller oynarlar. Oksijen gazı kararlı, daha az reaktiftir, ozon daha az kararlı, oldukça reaktiftir. Oksijen çoğunlukla atmosferin alt katmanlarında bulunur. Solunum ve enerji için hayati önem taşıyan oksijen (O2), Dünya atmosferinin %21’ini oluşturur. Ozon, stratosferde (“iyi”) ve troposferde (“kötü”) bulunur. Stratosferdeki ozon zararlı UV ışınlarını engelleyerek yaşamı korurken, troposferdeki (yer seviyesindeki) ozon kirletici bir maddeye dönüşür.
Kaynakça:
https://periodic-table.rsc.org/element/8/oxygen
https://www.jagranjosh.com/general-knowledge/difference-between-oxygen-and-ozone-1820002627-1
https://www.oxidationtech.com/ozone/ozone-basics/properties.html
https://www.diffen.com/difference/Oxygen_vs_Ozone
https://grokipedia.com/page/Allotropes_of_oxygen
https://scied.ucar.edu/learning-zone/air-quality/ozone
https://www.muhendisbeyinler.net/oksijen-nedir-ve-oksijenin-ozellikleri/
Yazar: YerelHaber
Diğer gönderilerimize göz at
[wpcin-random-posts]