hidrojen al
Tüm yıldızlar ve birçok gezegen çok miktarda hidrojen içerir, ancak Dünya’da serbestçe yüzen hidrojen miktarı çok düşüktür. Atmosferde on binde yaklaşık 7 parça oranında bulunur. Bu nedenle hidrojen üretilmelidir. Yerel hidrojen kaynakları fosil yakıtlar (CxHy) ve su (H2O) olarak gösterilebilir. Günümüzde hidrojen çoğunlukla doğal gaz, petrol ve kömür gibi fosil yakıtlardan üretilmektedir.
Bununla birlikte, uzay programları dışında, hidrojen henüz bir yakıt veya enerji taşıyıcısı olarak kullanılmamıştır. Bazı kimyasal ve metalürjik uygulamalarda ve ham petrolün oksidasyonu gibi rafinerilerde kullanılmıştır. Bugün, dünya çapında yıllık hidrojen üretimi yaklaşık 40 milyon tondur (5,6 EJ). Bir enerji taşıyıcısı olarak hidrojenin önümüzdeki yıllarda çok daha büyük miktarlarda üretilmesi gerekecektir.
Fosil yakıtlardan hidrojen üretimi
Doğal gazın buhar reformu
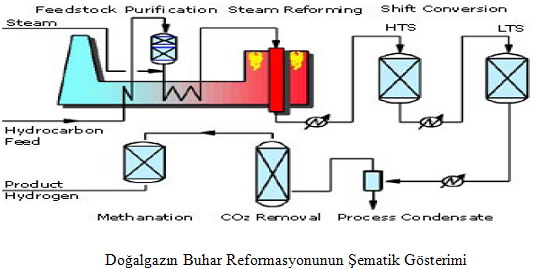
Hidrokarbonların (genellikle doğal gaz) buhar reformasyonu, hidrojen üretmenin en yaygın, ekonomik ve verimli yoludur. Yöntem basitçe 3 ana adımı içerir.
1- İmalat gazı üretimi 2- Su-gaz değişimi 3- Gaz arıtma
CH4 + H20 CO + 3H2; CO + H2O CO2 + H2; karbondioksit + 3H2 CH4 + H2O
Reforming reaksiyonu, doğal gaz veya fuel oilin yanması ile ortaya çıkan çok güçlü ve enerji tasarruflu bir endotermik reaksiyon olup, reaksiyon sıcaklığı genellikle 700-925 °C aralığındadır. Buhar reforming yönteminin verimliliği, enerji girdisi ve yaklaşık %65 ile %75 arasında üretilen hidrojen oranı ile hesaplanır ve üretilen hidrojenin fiyatı yaklaşık 6$/GJ’dir.
kısmi oksidasyon
Kısmi oksidasyon, hidrokarbonları naftadan daha ağır hale getirmek için kullanılır. Yakında, doğal gaz, etanol ve hatta benzin için kısmi oksidasyon dönüştürücüler, arabaları hareket ettirmek için yakıt hücreleriyle birlikte kullanılacaktır. Bu işlemdeki işlem sıcaklığı yaklaşık olarak 1150 ile 1350°C arasındadır.
Genel olarak, kısmi oksidasyon verimi, buhar reformasyonundan daha düşüktür ve yaklaşık %50’dir. Hidrojen yaklaşık 10$/GJ’den üretilebilir.
Doğal gazın termal ayrışması
Doğal gazın termal olarak ayrıştırılması, çeşitli ürünler elde etmek için uzun yıllardır kullanılan bir yöntemdir. Sıcaklığı 1400°C’nin üzerine çıkarmak için bir metan gazı alevi kullanılır. Bu yöntem oldukça ekonomiktir çünkü yan ürünler (siyah karbon) üretebilir. Hidrokarbonlardan hidrojen üretiminde karbondioksit emisyonu sağlamayan tek yöntem olduğu da unutulmamalıdır.
Kömür gazlaştırma
Kömürün gazlaştırılması sürecinde, pulverize kömür atmosferik basınç altında oksijen ve buhar ile hızla ayrışır ve oksitlenir. Kömürün gazlaştırılması, özellikle katı yakıt ve büyük miktarda atık külün taşınması gerekliliği nedeniyle çok karmaşık bir süreç haline gelmektedir. Kömür genellikle ucuz bir yakıt olarak görülse de, kömürün gazlaştırılması hidrojen elde etmenin ucuz bir yolu değildir. Hidrojen üretiminin fiyatı yaklaşık 12 ila 14 $/GJ arasında değişmektedir.
Biyokütleden hidrojen üretimi
Hidrojen, piroliz/gazlaştırma fonksiyonu ile biyokütleden elde edilebilir. Biyokütle, yüksek sıcaklık ve düşük basınç altında bir reaktörde işlenir. İşlem sonunda hidrojen, metan, karbondioksit, karbondioksit ve nitrojen elde edilir.Gaz akımlarının yüksek sıcaklığından dolayı hidrojen içeriği artar ve bu işlem sonunda yüksek saflıkta hidrojen elde edilebilir.
Tüm sistem, biyokütle hazırlama ünitesi ve reaktör tasarımı dışında bir kömür gazlaştırma tesisine çok benzer. Ayrıca biyokütlenin ısıl değerinin düşük olması nedeniyle kömür gazlaştırma tesisine göre daha geniş bir alana kurulmaktadır.
Sudan’dan hidrojen üretimi
elektroliz
Suyu doğru akım kullanarak hidrojen ve oksijene ayırma işlemine elektroliz denir. Hidrojen elde etmenin en basit yöntemi olarak bilinir. Prensip olarak, bir elektrolitik hücre, genellikle düz bir metal veya karbon plaka olmak üzere iki elektrot ve bunlara daldırılmış elektrolit adı verilen iletken bir sıvı içerir. Bu elektrotlara bir doğru akım kaynağı bağlandığında, iletken sıvıdaki akım pozitif elektrottan negatif elektrota doğru akacaktır. Sonuç olarak, elektrolit içindeki su katottan hidrojene ve anottan oksijene ayrışır. Burada sadece su ayrışır, ancak su iyi bir iletken olmadığı için, iletkenlik arttırıcı olarak elektrolite genellikle potasyum hidroksit gibi bir madde eklenir.
İdeal olarak, normal basınç ve sıcaklıkta suyun elektrolizi için 1,23 volt yeterli olacaktır. Elektroliz işleminde yavaş reaksiyon ve diğer sebeplerden dolayı daha yüksek voltaj ile kullanılır. Hidrojen üretim hızı, gerçek akım yoğunluğu ile orantılı olduğundan, ekonomik nedenlerle daha yüksek akım yoğunlukları tercih edilir. Bu nedenle pratikte suyun ayrıştırılması için her bir hücreye uygulanan voltaj genellikle yaklaşık 2 volttur.
Teorik olarak metreküp oksijen başına 2,8 kilovat-saat elektrik enerjisi yeterlidir, ancak yukarıda özetlenen nedenlerle pratikte kullanılan elektrik enerjisi miktarı metreküp hidrojen üretimi başına 3,9-4,6 kilovat-saat arasında değişmektedir. Buna göre elektroliz işleminin verimi %70 civarındadır. Ancak son yıllarda bu alanda yapılan ileri çalışmalar ve teknoloji sayesinde %90 verimlilik sağlanmıştır. Uygulamada kullanılan elektroliz hücrelerinde nikel kaplı çelik elektrotlar kullanılmaktadır.
Fosil yakıtlar çağında bol miktarda hidrojen üretmek için geliştirilebilecek tek yöntem elektroliz gibi görünüyor.Su elektrolizinden hidrojen üretimi basit altyapısı olan, 50 yılı aşkın süredir bilinen, yüksek verimli ve hareketli parçası olmayan bir sistemdir. .
Elektroliz reaksiyonu kimyasal olarak aşağıda verilmiştir.
Katot reaksiyonu: 2H2O (l) + 2H2 (g) + 2OH (sulu)
Anot reaksiyonu: 2OH (sulu) O2 (g) + H2O (l)
Tüm hücre reaksiyonu: H2O (l) H2 (g) + O2 (g)
Geliştirilen ileri elektroliz tekniklerinden bazıları aşağıda sıralanmıştır;
– Gelişmiş alkalin elektroliz, %90’a varan verimliliğe sahiptir.
Katı polimer elektroliz işlemi, bir protonu elektrolit olarak iletmek için bir iyon değişim elemanı kullanır. Bu tip elektrolizör çok yüksek akımlarda (2 A/cm?) çalışabilir.
-700-1000°C arasında çalışan yüksek sıcaklıkta buhar elektrolizi, elektrolit olarak oksijen iyonu iletken seramikler kullanır.
Suyun doğrudan termal bozunması (piroliz)
Su, 2000 K’nin üzerinde termal olarak ayrılabilir ve bu ayırma aşağıdaki denklemle temsil edilebilir.
H20 a H2O + b OH + c H + dO + e H2 + f O2
Ayrışma sürecinin sadece %1’i 2000 K’de, %8,5’i 2500 K’de ve %34’ü 3000 K’de gerçekleşir. Gaz karışım ürünü çok yüksek sıcaklıklardadır. Bu işlemdeki en büyük sorun, reaksiyonu gerçekleştirmek için gerekli olan malzemelerin bu sıcaklığa dayanamamasıdır. Önümüzdeki yıllarda, malzemelerin daha yüksek sıcaklıklara dayandığı keşfedildiğinden bu yöntem daha popüler hale gelebilir.
termokimyasal döngüler
Hidrojen termokimyasal üretimi, suyun termal ayrışma için gereken sıcaklıktan daha düşük sıcaklıklarda kimyasal ayrışmasına izin verir. 1960’ların ortalarından bu yana, yaklaşık 2-3.000 termokimyasal döngünün hidrojen ürettiği bulunmuştur, ancak bugün bunların sadece 20-30’u hidrojen üretimi için mevcuttur.
Bunlardan bazıları şunlardır;
Sülfürik asit-iyot döngüsü
Hibrit sülfürik asit döngüsü
– Hibrit kömür döngüsü sülfürik asit ve hidrojen
Kalsiyum oksit döngüsü – iyot bromür
Sıcaklığa bağlı olarak değişmekle birlikte bu yöntemle çok yüksek verim (%40-50) elde etmek mümkündür. Ancak kimyasallardan salınan zehirli atıklar ve yüksek sıcaklıklarda malzemelerde meydana gelen korozyon sorunu yöntemin geliştirilmesi için çözülmesi gereken problemler arasındadır.
fotoliz
Fotoliz, sudan hidrojen elde etmek için enerji kaynağı olarak gün ışığını kullanan ve fotobiyolojik sistemler, fotokimyasal dönüştürücüler veya fotoelektrokimyasal hücreler ile desteklenebilen bir sistemdir ve bu yöntem üzerinde yeni ve cesaret verici çalışmalar yapılmaktadır.
Bor minerallerinden hidrojen üretimi
Ülkemizde bor minerallerinin yaklaşık %64’ü bulunmakta olup, bor minerali sanayide 250’den fazla alanda kullanıldığı için bu miktar doğru kullanıldığı takdirde büyük bir potansiyeldir. Bor, 1950’lerden beri en çok çalışılan minerallerden biri olmuştur. Bu noktada bor metalinin 3 özelliği üzerinde durulabilir.
Borun hidrojen taşıyıcısı olarak kullanılması
Hidrojenden daha iyi bir enerji hammaddesi olmak
Füzyon reaktörlerinde yakıt olarak kullanılır.
Bor araştırmalarından birinde geliştirilen bir teknolojide, enerji elde etmek için kullanılan hammaddeler saf su ve sodyum hidrittir. Sodyum bor hidrit, sodyum bor tuzunun rafine edilmesiyle elde edilen ve deterjan üretiminde kullanılan bir üründür. Bu ileri teknoloji, taşınabilir güç kaynağı pilleri ve ulaşım için uygun bir teknoloji haline geldi. Sodyum borohidritin yakıt hücrelerinde kullanılması, fosil yakıtlardan daha pahalı, elde edilmesi, depolanması ve taşınması zor olan hidrojenin dezavantajlarını da ortadan kaldırmıştır.
NaBH4(ler) + H2O? 4H2 + NaBO2
Suda çözünen sodyum borohidrit karışım olarak depolanır ve enerji üretmek için hidrojene ihtiyaç duyduğunda o karışıma uygulanan katalizör ile kimyasal reaksiyon başlatılır. Reaksiyon sonucunda gaz halinde kalan hidrojen ise yakıt pili vasıtasıyla elektriğe dönüştürülür veya içten yanmalı motorlarda doğrudan yakıt olarak kullanılır.
Diğer gönderilerimize göz at
[wpcin-random-posts]