Gizli ısı, maddenin fazındaki değişikliklerle ilişkilidir. Spesifik olarak, bir katı, gaz veya sıvı fazı değiştirdiğinde bir madde tarafından yayılan veya emilen enerji olarak tanımlanır. Aynı zamanda, tüm sistemin sıcaklığını yükseltmeden bir madde tarafından verilen veya salınan potansiyel enerjidir. Bütün maddeler katı, sıvı ve gaz olmak üzere iki tür enerjiden oluşur. Biri parçacıkların hareketinden kaynaklanan kinetik enerji, diğeri ise bu parçacıkların sistemdeki konumuna karşılık gelen potansiyel enerjidir. Farklı maddelerle ilgili bir diğer bilgi de fazlarına göre yapılarının değiştiğidir.
Örneğin, su söz konusu olduğunda, katı haldeki buz ve gaz halindeki buhar olarak bilinir. Buzdaki su molekülleri birbirine çok yakındır ve bu da tam şekilleri ile tutarlıdır. Ayrıca, buzdaki parçacıklar daha yüksek bir kuvvetle birbirine bağlandığı için kinetik enerji de ihmal edilebilir düzeydedir. Öte yandan, su molekülleri buhar halinde birbirinden uzaktır, bu nedenle buhar fazındaki moleküllerin kinetik enerjisi maksimumdur. Bir maddenin sıcaklığını yükseltmeden fazını değiştirmek için gereken ısıya gizli ısı denir. Bu terim kelimenin tam anlamıyla gizli anlamına gelir çünkü bu enerji, bir faz değişimi meydana gelene kadar moleküllerin içinde saklıdır. Su söz konusu olduğunda, faz değişikliğine neden olmak için ısının yeterli olduğuna dikkat edin. Örneğin, bir tencereye su döküp gaz ocağını açtığınızda su hemen kaynamaya başlamaz, bunun yerine birkaç dakika sonra kabarcıklar oluşmaya başlar ve tencere bir kapakla kapatıldığında kapak kapanır. mümkün olan en kısa sürede buharla kaplanır.
Buz eriyip sıvı suya dönüşürse yani faz değişimi sırasında ısı transferinden sıcaklık değişimi olmaz. Örneğin, güneş tarafından ısıtılan bir yüzeye eriyen kar tanelerinden düşen su düşünüldüğünde, aksine, düşük sıcaklıktaki ortam tarafından soğutulan bir buz tepsisinde su donar.
Bir katıyı eritmek için enerji gereklidir, çünkü moleküllerin kinetik enerjilerle karşılaştırması ve hareket etmesi için katıdaki moleküller arasındaki yapışkan bağların kırılması gerekir; Bu nedenle sıcaklıkta bir artış olmaz. Benzer şekilde, bir sıvıyı buharlaştırmak için enerji gereklidir, çünkü sıvının molekülleri birbirleriyle çekici kuvvetlerle etkileşime girer. Hal değişimi tamamlanana kadar sıcaklıkta herhangi bir değişiklik olmaz. 0 °C’deki bir bardak limonatanın sıcaklığı başlangıçta tüm buzlar eriyene kadar 0 °C’de kalır. Tersine, donma ve yoğuşma sırasında genellikle termal enerji şeklinde enerji açığa çıkar. Moleküller bir araya getirildiğinde yapışma kuvvetleri tarafından yapılır ve bir arada kalmak için karşılık gelen enerjinin dağılması gerekir. Bir faz değişiminde yer alan enerji, iki ana faktöre, bağların veya kuvvet çiftlerinin sayısına ve gücüne bağlıdır. Bağ sayısı, molekül sayısı ve dolayısıyla numunenin kütlesi ile orantılıdır. Kuvvetlerin gücü parçacıkların türüne bağlıdır.
İçindekiler
faz geçişleri
Faz geçişleri, bir sıvı oluşturmak için bir katıdaki moleküller arasındaki çekici kuvvetlerin kısmen üstesinden gelmek için enerji gerektirir. Buzlanmanın oluşabilmesi için aynı gücün kaldırılması gerekir. Moleküller, sıvıdan buhara giden yolda büyük mesafelerle ayrılır ve moleküler çekimin üstesinden gelmek için büyük enerji gerekir. Yoğuşmanın oluşabilmesi için aynı enerjinin uzaklaştırılması gerekir ve faz değişimi tamamlanana kadar sıcaklıkta herhangi bir değişiklik olmaz.
buzu ısıtmak
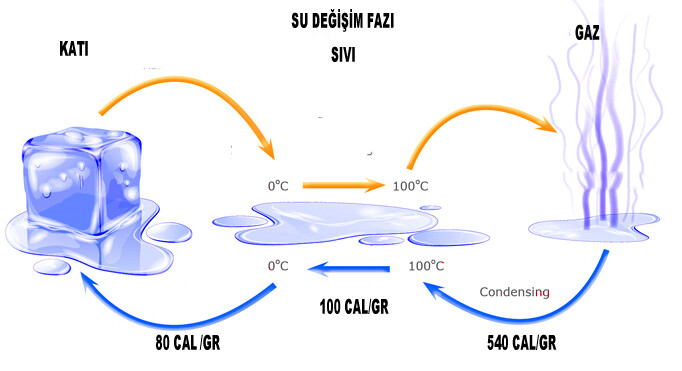
Buzun ısıtılması, faz değişimlerinde büyük miktarda enerji içerir. Örneğin, 0°C’de 1 kilogram su yapmak ve 0°C’de 1 kilogram buzu eritmek için ne kadar enerji gerekir? Suyun sıcaklık ve değer değişimi (334 kJ/kg) denklemini kullanarak, Q = mLf = (1,0 kg) (334 kJ/kg) = bir kilogram buzu eritmek için gereken 334 kJ enerji. Bu büyük miktarda bir enerjidir, çünkü 1 kg sıvı suyun sıcaklığını 0°C’den 79,8°C’ye çıkarmak için gereken enerjiyle aynıdır. Suyu buharlaştırmak için daha fazla enerjiye ihtiyaç vardır ve normal kaynama noktasında (atmosfer basıncında 100 °C) 1 kg sıvı su buharını değiştirmek için 2256 kJ gerekir. Bu örnek, bir faz değişiminin enerjisinin, faz değişimi olmadan sıcaklık değişimleriyle ilişkili enerjiye kıyasla çok büyük olduğunu göstermektedir.
Faz değişikliklerinin muazzam bir dengeleyici etkisi vardır. Başlangıçta -20 °C’de buz örneğine sabit bir oranda ısı eklendiği göz önüne alındığında, buz sıcaklığı başlangıçta doğrusal olarak yükselir ve 0 °C’ye ulaşana kadar 0,50 kcal/h sabit bir oranda ısı emer. Bu sıcaklığa ulaşıldığında, tüm numune eriyene kadar buz erimeye başlar ve toplam 79.8 kcal/g ısı emer. Bu faz değişimi sırasında sıcaklık 0 °C’de sabit kalır. Buzun tamamı eridikten sonra, sıvı su ısınır ve 1.00 cal/°C’lik yeni bir sabit oranda ısı emer.Ayrıca, belirli sıcaklıkların faza bağlı olduğu da belirtilmelidir. Tüm sıvı buharlaştığında, su 100°C’de kaynamaya başlar ve bu faz değişimini tamamlamak için su 539 kcal/g ısı emene kadar sıcaklık tekrar sabit kalır.
ısıtma ve sudaki değişiklikler
Isıtma ve su değişimleri, eklenen enerjiye karşı sıcaklığın bir grafiğidir. Sistem, buz ısınarak sıvı suya dönüşürken buharın buharlaşmaması ve buharlaşma meydana geldiğinde buharın sistem içinde kalması için yapılandırılmıştır. 0 °C ve 100 °C’deki sabit sıcaklık değerlerinin uzun uzantıları, sırasıyla büyük erime ve buharlaşma gizli ısısını yansıtır.
Gizli füzyon ısısı nedir?
İki bardak soda verildiğinde, A’nın bir bardak soğuk sodası varsa ve B’nin içinde buz küpleri bulunan bir bardak sodası varsa, B’nin daha uzun süre soğuk kaldığı açıktır. Gizli füzyon ısısının devreye girdiği yer burasıdır. Bir katıyı sıvıya dönüştürmek veya tam tersini yapmak için gereken ısı olarak tanımlanır. Dikkat edilmesi gereken önemli bir nokta, bu değişimin sıcaklıkta bir değişiklik olmadan da gerçekleştiğidir. Bir katıyı sıvıya dönüştürmeye çalışırken, sisteme ısı verilmesi gerekir. Öte yandan, bir sıvı katıya dönüştüğünde gizli füzyon ısısı verilir. Buzdaki gizli füzyon ısısı, özgül ısıdan çok daha yüksektir, bu nedenle içecekleri daha uzun süre soğuk tutar. Ayrıca buz ve sudaki yüksek gizli ısı değeri de buzun yavaş erimesinden sorumludur.
Gizli buharlaşma ısısı nedir?
Gizli buharlaşma ısısı, bir sıvıyı buhara dönüştürmek için gereken enerji miktarıdır. Belirtildiği gibi, su büyük miktarda gizli ısı tutabilir. Gizli buharlaşma ısısı nedeniyle, buhar yanıkları sıcak sudan kaynaklanan yanıklara kıyasla çok ciddidir. Çünkü buhar elde yandığında yoğunlaşmaya başlar. Bu nedenle, sıcak suyun yapmadığı bu yoğuşma için daha fazla enerji kullanır. Sonuç olarak su buharı yanıkları bu faz değişiminden dolayı çok tehlikelidir.
Sıcaklık değişmezse, uygulanan ısı nereye gider?
Makale boyunca, gizli ısının sıcaklıkta bir değişikliğe neden olmadığı, bu nedenle bir tencere suyu ısıttığınızda sıcaklığın hemen yükselmediği belirtilmektedir. Bunun nedeni, uygulanan ısının önce ortamın fazını değiştirmek için bağlarını kırmak için kullanılmasıdır. Sudaki moleküller birbirine çok yakın olduğundan, dış ısı bağları kırarak kinetik enerjiyi arttırır ve sıvıyı buhara dönüştürür.
kaynak:
ncas.ac.uk
sokratik.org
zihinsel olarak
Doğa.com
yazar: Özlem Güvenç Ağaoğlu
Diğer gönderilerimize göz at
[wpcin-random-posts]