hidrojen nedir?
Hidrojenin protonyum, döteryum ve trityum adı verilen 3 izotopu vardır. Elementlerin en basiti olan standart hidrojen atomu (protonyum), bir proton ve bir elektrondan oluşur. Moleküler hidrojenin (H2) iki formu vardır. Bunlar ortohidrojen ve parahidrojendir. Her iki durumda da aynı kimyasal özellikler görülür, ancak yörünge farklılıklarından dolayı bazı farklı fiziksel özellikler gösterirler. Oda sıcaklığında, hidrojen yaklaşık %75 ortohidrojen ve %25 parahidrojenden oluşur. Yarı hidrojen düşük sıcaklıklarda daha kararlı olduğu için konsantrasyonu artar. Teorik olarak yarı hidrojen, sıvı hidrojende %100 durumuna ulaşır.
Hidrojen, Dünya’daki en yaygın elementtir. Dünya yüzeyinin %60’ından fazlasının su parçalarıyla kaplı olduğunu düşünürsek, bunun gerçeği kolayca görülebilir. Bununla birlikte, hidrojen nadiren doğada bağımsız olarak bulunur. Bu nedenle, onu elde etmek için bir dizi işlem yapmak gerekir.
hidrojenin özellikleri
Hidrojen, bazı benzersiz özelliklere sahip ideal bir enerji taşıyıcısıdır:
– Elektrik enerjisi kullanılarak yüksek verimle üretilebilir veya elektrik üretiminde kullanılabilir.
Hidrokarbonlardan ve sudan üretilebilir. Doğrudan güneş enerjisinden hidrojen üretme (elektrokimyasal veya fotobiyolojik üretim) süreçleri yoğun bir şekilde araştırılmaktadır.
Ateşleme, katalitik yanma, elektrokimyasal dönüşüm ve hidrasyon gibi birçok yöntemle enerji üretmek için etkin bir şekilde kullanılabilir.
Hidrojen enerjisi üretiminde son ürün sudur.
– yenilenebilir kaynaklardan üretilen elektrikten üretildiğinde çevreye herhangi bir emisyon yaymaz; Yani çevre dostudur (bazı nitrojen oksitler sadece alevin havada yanmasıyla oluşur).
Bir gaz, sıvı veya mineral hidratta saklanabilir.
– Boru hatları veya tanklarla çok uzun mesafelere taşınabilir.
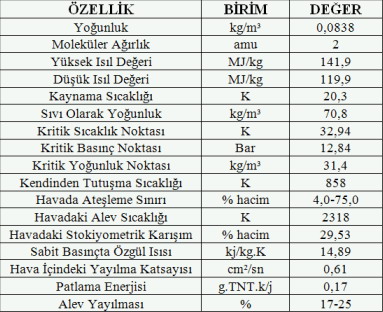
Hidrojenin fiziksel özellikleri
Hidrojenin havaya göre yoğunluğu 0,07’dir ve bu bakımdan cisimlerin en hafifidir. Bu nedenle gözenekli duvarlardan diğer gazlara göre daha hızlı geçer. Ayrıca aşırı ısıtılmış demir, platin ve iridyum gibi metalleri de süzer. Hidrojen, helyumdan sonra sıvılaştırılması en zor ikinci gazdır. Geçiş sıcaklığı -240°C olan hidrojen, atmosfer basıncında -253°C’de kaynar ve -259°C’de katılaşır. Çok iyi bir ısı iletkenidir. Kendi hacminin bin katı kadar çözünebilen paladyum gibi bazı metaller tarafından kolayca emilir.
Hidrojen kimyasal özellikleri
Hidrojenle aktive olan formları dışında soğuk algınlığında pek etkili değildir. Isıda veya katalizörlerin varlığında birçok reaksiyona girer. Değerli bir element olduğu için çok belirgin bir fotovoltaik özelliği vardır. Alkali metal oksitler (AL2O3) gibi çok kararlı bileşikleri indirgeyemeyen oldukça güçlü bir indirgeme maddesidir. Ancak, NiO, CuO, vb. Birçok metal oksidi azaltır. Bu şekilde katalizör olarak kullanılan çok indirgenmiş metaller elde edilir.
Hidrojen, çoğu metal olmayanın yanı sıra alkalin ve toprak alkali metallerle doğrudan birleşir. Hidrazit vermek için dört halojenin tümü ile reaksiyona girer. Flor iyota doğru hareket ettikçe, hem reaksiyon hızı hem de salınan ısı miktarı azalır. Kırmızı sıcaklıkta veya daha düşük sıcaklıkta bir katalizör varlığında oksijenle birleşerek su verir. Mavi bir alevle yanar. 250°C’de kükürt ile birleşir ve yüksek basınçta nitrojen ile bir katalizör eşliğinde birleşerek amonyak sağlar. Kurşun ve bakır gibi değerli metallerin oksitlerini azaltır. Demir ve demirli metallerin oksitleri ile tersinir reaksiyonlar verir. Ayrıca, işlemin gerçekleştiği koşullara (sıcaklık, basınç, katalizör) bağlı olarak farklı ürünler oluşturarak karbon monoksiti azaltır.
Diğer gönderilerimize göz at
[wpcin-random-posts]