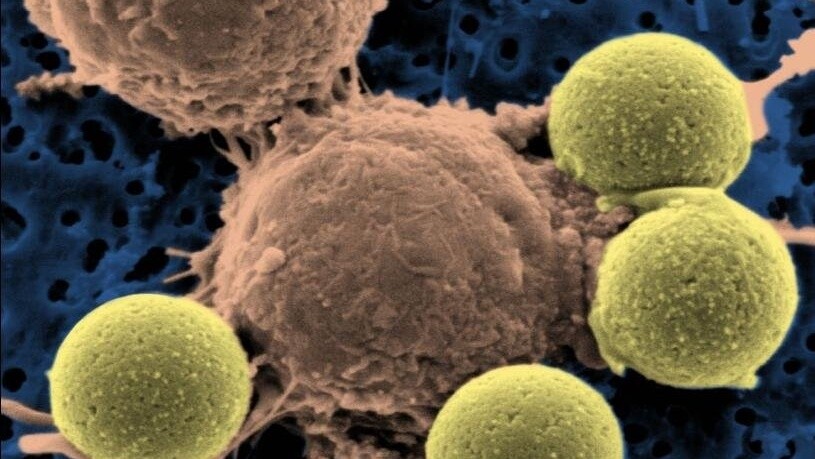
Nisan 2012’de Emily Whitehead, genetiği değiştirilmiş T hücreleri (bağışıklık sisteminde bulunan bir hücre türü) alan ilk pediatrik hasta oldu. Ölümcül akut lenfoblastik lösemiyi (ALL) tedavi etmek için bu hücreleri aldı. Tedavisinin üçüncü haftasında Emily’nin lösemisi düzelmeye başladı ve bugün 12 yaşında sağlıklı bir kız. Diğer genç hastalarda benzer başarılı sonuçların ardından FDA, kimerik antijen reseptörü (CAR) T-hücre tedavisi Kymriah’ı ALL’li çocuklarda ve 26 yaşından küçük yetişkinlerde kullanım için onayladı. Bu kararla Kymriah, Amerika Birleşik Devletleri’nde Gıda ve İlaç İdaresi tarafından onaylanan ilk gen tedavisi oldu.
CAR T hücre tedavileri de canlı ilaçlar olarak sınıflandırılır. Bu ilaç, onu bağışıklık sistemi tepkisini bastırmak için kullanacak olan hasta için özel olarak tasarlanmıştır. Doktorlar, her hastaya özel bir hücre tedavisi üretmek için önce hastanın kan hücrelerini toplar ve numuneyi bağışıklık sisteminden T hücreleriyle zenginleştirir. Spesifik bir protein reseptörünü kodlayan gen, virüse eklenir. Burada kullanılan virüs bir lentivirüstür ve ilgili geni hücreye aktarmak için aracı olarak kullanılır. Geni içeren virüs T hücrelerine aktarılır ve T hücreleri modifiye edilir. Bu protein reseptörü, T hücrelerine göre yeni bir avantaj sağlar. Bu özelliği sayesinde hastanın T hücreleri kanser hücrelerini tanıyıp öldürebilmektedir.
Modifiye T hücreleri bir laboratuvarda büyütülür ve bir hastaya milyonlarca hücre şeklinde verilir. Bu süreç, kalite ve güvenilirlik denetimleri ile iki haftadan kısa sürede tamamlanır.
ABD Gıda ve İlaç İdaresi (FDA) onayı, klinik deneylerin sonuçlarına göre verildi. Denemelerde 63’ü çocuk ve genç yetişkin olmak üzere 107 kişiye Kymriah verildi ve hastaların yüzde 83’ü üç ay içinde iyileşti.
Kymriah’ın da yan etkileri olabilir. Bu yan etkilerden biri sitokin salınım sendromudur (CRS). Bu sendromda yüksek ateş, grip benzeri semptomlar ve ölümcül olabilen nörolojik problemler gibi sistemik reaksiyonlar ortaya çıkabilir. CRS’nin tedavisi için FDA, bir immünosüpresif artrit ilacının kullanımını onaylamıştır.
Kymriah’ın maliyeti 475.000 dolar. Fiyatının yüksek olması tedavinin rutin olarak uygulanmasını zorlaştırmaktadır. Bu nedenle, araştırma grupları da tedavi maliyetini azaltmak için çalışıyor. Novartis, Kymriah’ın Amerika Birleşik Devletleri’ndeki 32 tedavi merkezinde hastaların hizmetine sunulacağını duyurdu. Ayrıca CAR-pozitif T-hücre tedavisini solid tümörlere de uygulanabilir hale getirmek için çalışmalar devam etmektedir. Katı tümörler için üzerinde çalışılan bir tedavi stratejisi, T hücrelerini doğrudan tümöre sokmayı amaçlar.
Kalıtsal körlüğün tedavisi için gen tedavisi
Kalıtsal bir hastalık için ilk gen tedavisi stratejisi, Gıda ve İlaç İdaresi tarafından onaylanmıştır. Bu tedavi stratejisinin amacı, çocuklarda kalıtsal körlüğü tedavi etmekti. Luxturna adı verilen bu tedavi, belirli bir gende (RPE65 geni) hastalığa neden olan bir mutasyonu (bir gendeki DNA dizisinin değişmesi) hedefleyen ilk onaylı gen terapisidir.
RPE65 genlerinde mutasyonlarla doğan insanlar, gece körlüğü de dahil olmak üzere ciddi görme bozukluklarına sahiptir. Hastalık ilerledikçe insanlar tüm görme fonksiyonlarını kaybederler ve sonunda tamamen kör olurlar.
Luxturna, hastalığa neden olan mutasyona sahip genin yerine mutasyon içermeyen RPE65 geninin bir kopyasını yerleştirir. Tedavi için RPE65 geninde mutasyon olan çocuk ve yetişkinlerin gözüne enjeksiyon yapılır. Bu enjeksiyonun amacı, adenovirüs tarafından taşınan RPE65 geninin mutasyonsuz bir kopyasını retina hücrelerine iletmektir. Böylece göz onarımı başlamış olur. Ancak Luxturna teknik olarak tam bir tedavi değildir. Hastalığın ilerlemesini durdurmak ve görme kalitesini artırmak için her göze bir kez yapılan cerrahi bir enjeksiyondur. Tedavinin maliyetinin bir milyon doları bulabileceği tahmin ediliyor.
ABD Gıda ve İlaç İdaresi tarafından onaylanan her iki gen tedavi yöntemi de klinikte hastalarda başarılı sonuçlar veren yöntemlerdir. Bu tedavilerin yanı sıra gen terapi yöntemlerinin ortaya çıkması, onaylanması ve diğer hastalıklarda yaygınlaşması olasıdır. Ancak tedavi yöntemlerinin hastalara yaygınlaştırılmasında elde edilen başarılı sonuçların yanı sıra maliyetin düşürülmesi ve fiyat açısından tedaviye kolay erişimin sağlanmasına yönelik çalışmalar da yapılmaktadır.
Kaynak:
1) http://genomemag.com/2017/10/fda-approves-first-gene-therapy-for-leukemia/
2) https://www.scientificamerican.com/article/fda-approves-first-gene-therapy-targeting-rare-form-of-inherited-blindness/
yazar: Ayka Olkay
Diğer gönderilerimize göz at
[wpcin-random-posts]