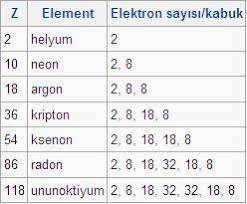
Soy gazlar, özel koşullar altında kokusuz ve renksiz olan, reaksiyona girmemiş bir grup elementtir. Helyum, neon, argon, kripton, ksenon ve radon elementleri soy gazlardır. Hiçbir şeyle reaksiyona girmemelerinin nedeni, onları kararlı kılan sekiz değerlik elektronlarına sahip olmalarıdır. Ancak helyum bir istisnadır çünkü sadece iki değerlik elektronuna sahip olmasına rağmen asil bir gazdır.
Almancadan çevrilen soy gaz ilk olarak 1898 yılında Hugo Erdmann tarafından keşfedilmiştir. Periyodik tabloda 18. grup soy gazdır. Tüm soy gazlar kırılgan bir atomlar arası güce sahiptir. Ayrıca, artan elektron sayısı nedeniyle hepsinin atom yarıçapı sürekli olarak artar. Dünyadaki bazı soy gazlar atom numaralarına bağlıdır. Örneğin helyum, atom numarası nedeniyle en yaygın soy gazdır.
Soy gazlar ayrıca nispeten düşük kaynama noktalarına ve erime noktalarına sahiptir. Hepsi, belirli bir basınç veya sıcaklık gibi belirli koşullar altında olduklarında monomerik gazlardır. Periyodik tabloda aşağı doğru inildikçe erime ve kaynama noktalarınız da artacaktır. Soy gaz grubunun, atomları nedeniyle diğer elementlerle birleşmediği için sıfır grubunun bir parçası olduğu düşünülüyordu. Ayrıca sıfır değerine sahip olduğuna inanılıyordu. Bununla birlikte, çok geçmeden asil gazların gerçekten de diğer elementleri içeren ve sekiz değerlik elektronuna sahip bazı bileşikler oluşturduğunu keşfettiler.
Soy gazların çoğu William Ramsay tarafından keşfedilmiştir. Kripton, neon ve xenon’u keşfedin. Soy gazların çok düşük kaynama ve erime noktaları vardır, bu da onları soğutucu akışkanlarda çok kullanışlı kılar. Aydınlatmada da yaygın olarak kullanılmaktadır. Bu, onları çoğu kimyasala karşı tepkisiz hale getirir, bu da bu asil gazları mükemmel aydınlatıcılar yapar.
İçindekiler
ben gaslar
helyum
Helyum soy gazlardan biridir. Periyodik tabloda iki numara, yani iki protonu ve iki elektronu var. Onun sembolü. Helyumun kaynama ve erime noktaları, tüm elementlerin en düşük olanıdır. Helyum aslında adını Yunan güneş tanrısı Helios’tan almıştır. Çünkü güneşte keşfedildi.
Helyumun fiziksel fazı bir gazdır. Erime noktası 0,95 K ve kaynama noktası 4,222 K’dir. Helyum ilk olarak Güneş’te parlak sarı bir renk olarak bulundu. İlk başta helyum yerine sodyum olarak kabul edildi. Helyum havadan daha hafif olduğu için hava gemilerinde, balonlarda ve balonlarda sıklıkla kullanılır. Helyum bu uygulamalar için tamamen güvenlidir çünkü yanmaz veya diğer kimyasallarla reaksiyona girmez (çünkü yanıcı bir gazdır). Bir helyum balonu yavaşça söner çünkü helyum balonlardan karbondioksitten daha hızlı sızabilir veya kaçabilir.
Balonlar kullanılmadan çok önce hidrojen kullanıldı. Ancak helyum yanmadığından veya başka hiçbir şeyle reaksiyona girmediğinden insanlar helyumu kullanmaya başladı.
neon
Neon’un on protonu ve sekiz değerlik elektronu vardır ve ikinci soy gazdır. Sembolü, 1898’de keşfedildi. Parlak kırmızı bir spektrum yaydığında yeni bir element olarak kabul edildi. Aynı zamanda evrende ve güneş sisteminde çok bol bulunan bir elementtir. Ancak, Dünya’da nadirdir. Kimyasal olarak inert olduğu için yüksüz kimyasal bileşikler oluşturmaz. Neonun fiziksel formu, erime noktası 24.56 K olan bir gazdır. Neonun kaynama noktası 27.104 K’dir. Aynı zamanda ikinci en hafif inert gaz olarak kabul edilir. Neonun tam olarak üç kararlı izotopu vardır. Plazma tüplerinde ve soğutma uygulamalarında yaygın olarak kullanılmaktadır. Neon, 1852’de Sir William Ramsay ve Maurice Travers tarafından keşfedildi. Neonun elektron konfigürasyonu 2s22p6’dır.
Argon
Argon’un atom numarası on sekiz ve sembolü Ar’dır. Dünyadaki en yaygın üçüncü gazdır. Yaygındır ve çoğunlukla yer kabuğunda bulunur. Argon kelimesi, aktif olmayan anlamına gelen Yunanca bir kelimeden türetilmiştir. Dolayısıyla o argoya istinaden hiçbir şeye tepki göstermez. Argon, yüksek voltajlı bir elektrik alanına yerleştirildiğinde mor bir ışık yayar. Genellikle akkor veya flüoresan aydınlatmada kullanılır. Argonun erime noktası 83.81 K ve kaynama noktası 87.302 K’dir. Argonun çözünürlüğü, sudaki oksijeninkiyle hemen hemen aynıdır. Argon soylu bir gazdır, ancak bazı bileşikler oluşturabilir. Argon, karışık bir hidrojen ve flor bileşiği olan argon florohidrür oluşturabilir. 17k altında stabildir. Argon gazı deşarj tüplerinde kullanılabilir ve hatta mavi ve yeşil gaz lazerleri üretir. Ayrıca, bir argon flüoresan kızdırma başlatıcı takılabilir. İlk olarak 1785’te Henry Cavendish tarafından keşfedildi. Yerel dilin bir hava elementi olduğundan şüpheleniyordu. Argon aynı zamanda keşfedilen ilk asil gazdı ve 1957 yılına kadar kimyasal sembolü A idi. Bilim adamları artık Ar harfini sembol olarak değiştirdiler.
Kripton
Bir gaz olan kripton, 1898 yılında Sir William Ramassi tarafından keşfedilmiştir. 36 proton ve atom numarası 36 olan bir elektron içerir ve sembolü Kr’dir. Diğer birçok soy gaz gibi, aydınlatma ve fotoğrafçılıkta kullanılır. Adı, Yunanca gizli kelimesinden türetilmiştir. Kriptonun erime noktası 115.78 K ve kaynama noktası 119.93 K’dir. Kripton florür lazerlerde yaygın olarak kullanılır. Neon gibi bazı bileşikler de oluşturabilir. Kripton plazması da çok güçlü bir gaz düğmesi olarak kullanılıyor.
ksenon
Xe, ksenonun kimyasal sembolüdür. Elli dört atom numarasıdır. Diğer tüm soy gazlar gibi renksiz ve kokusuzdur. Ksenon ayrıca, ksenon hekzafloroplatinat haline gelmek gibi birçok kimyasal reaksiyona girebilir. Xenon özellikle flaş ışıklarında ve diğer lamba türlerinde kullanılır. Aynı zamanda kimyasal reaksiyonlara girebilen birkaç soy gazdan biridir. Normalde hiçbir şeyle etkileşime girmezler. Ksenon tam olarak sekiz kararlı izotop içerir. Ksenonun orijinal fazı gazdır. Erime noktası 161.40 K’dir. Kaynama noktası 165.051 K’dir ve ksenonun Pauling ölçeğine göre elektronegatifliği 2.6’dır.
radon
Radon, radyoaktif bir soy gazdır. Sembolü Rn’dir ve atom numarası seksen altıdır. Bu, radonun 86 proton ve elektrona sahip olduğu anlamına gelir. Doğal olarak ayrışmış radyumun bir ürünüdür. Aynı zamanda gaz halinde kalan en yoğun maddelerden biridir. Radon, radyoaktivitesi nedeniyle bir sağlık tehlikesi olarak kabul edilir. Radonun erime noktası 202 K ve kaynama noktası 211.5 K’dir. Ayrıca oda sıcaklığında en yoğun elementlerden biridir. Radon ayrıca kararlı bir izotopa sahip değildir.
bir gece
Unnoctium hala bir asil gaz olarak kabul edilebilir, ancak bu konuda şüpheler var. Onun fazı katıdır. Sembolü Uuo ve atom numarası yüz on sekizdir. Radyoaktif Unnoctium var. Radon gibi çok kararsız ve güvensiz. Fiziksel formu katıdır. Kaynama noktası 350 ± 30 K.
kaynak:
https://owlcation.com/stem/What-is-so-noble-about-Noble-Gases
yazar: Meltem Yıldırım
Diğer gönderilerimize göz at
[wpcin-random-posts]