Kas kasılması için gereken enerji ATP’den gelir. Ancak kaslarda o kadar az ATP depolanır ki, birkaç sarsıntı onu hızla tüketir. Neyse ki, kaslarda başka bir yüksek enerjili fosfat depolanır.
Omurgalılarda ve bazı omurgasızlarda, özellikle derisi dikenlilerde, bu bileşik, yüksek enerjili bir fosfat grubunun organik azotlu asit kreatine bağlanmasıyla oluşan kreatin fosfattır. Birçok omurgasız, benzer bir bileşik olan arginin fosfat kullanır. Bu iki bileşik (kreatin fosfat ve arginin fosfat) fosfajenler olarak adlandırılır. Fosfagin, kas kasılma mekanizmasına doğrudan enerji sağlayamaz; Ancak yüksek enerjili fosfat gruplarını ADP’ye bağışlayarak ATP’nin oluşmasına neden olurlar ve ATP de kasılma için doğrudan bir enerji kaynağı sağlar. Glikoliz ve hücresel solunum mekanizmasının hızlanması için birkaç saniye içinde güçlü bir kasılma için yeterli olan yüksek enerjili fosfatlar kaslarda depolanır. Kaslar aşırı kullanılmazsa, fosfaj ve ATP depolarını yenilemek için kullanılan enerjinin çoğu, besinlerin karbondioksit ve suya tamamen oksidasyonundan gelir. Solunum ve dolaşım sistemlerinin uyum sağlamasına ve gönderilen oksijen miktarının aktif kaslara aktarılmasına kadar geçen sürede kırmızı kasta oksidatif fosforilasyon için gerekli olan oksijenin bir kısmı oksijenli miyoglobinden sağlanır. Miyoglobin, kas hücrelerine özgü oksijen depolayan özel bir proteindir ve çok fazla O2 olduğunda ona bağlanmayı zayıflatır ve en çok ihtiyaç duyulana kadar depolar.
Yoğun egzersiz veya ağır bir şey kaldırma gibi yoğun kas aktivitesi sırasında, kasların (özellikle beyaz kasların) enerji talepleri herhangi bir yardım olmaksızın tek başına nefes alarak karşılanamayacak kadar artar; Çünkü yeterli oksijen dokulara gereken hızda ulaştırılamaz. Bu koşullar altında laktik asit fermantasyonu gerçekleşir.
Kaslar ihtiyaç duydukları ekstra enerjiyi anaerobik yoldan, şekeri parçalayarak ve fizyologların hipoksi dedikleri şeyi yaratarak alırlar. Bir miktar laktik asit kaslarda depolanır. Ancak çoğu kan yoluyla hızla karaciğere taşınır. Hiperaktivite sona erdikten sonra güçlü, hızlı nefes alma dönemi başlar. Bu şekilde, karaciğer bol miktarda O alır. Böylece karaciğer laktik asidi piruvik aside dönüştürür. Karaciğer bu şekilde elde ettiği enerjiyi kullanarak pirüvik asidin bir kısmını okside eder ve laktik asidin geri kalanından glikojeni geri dönüştürür. Bu şekilde hipoksi kapanır.
ATP, kas kasılması için doğrudan enerji kaynağı ise, o zaman ATP kasılma sürecine nasıl dahil olur ve bu süreç nasıldır? Kas analizi, kasılma bölümlerinin ana bileşenlerinin iki protein, aktin ve miyozin olduğunu gösterdi. Miyosin, konformasyonel değişiklik için ATP’yi kullanır ve bu değişiklik hareket yaratır. Ancak miyozin kasta başka bir formda bulunur ve her iki protein de düzenli sıralar halinde düzenlenmiştir. Bu tasarımın kas hücrelerinin özel yeteneklerini nasıl yarattığına bakacağız.
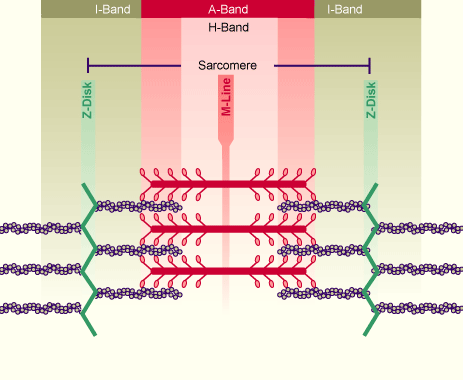
İskelet kaslarının özelliğinin, açık ve koyu renkli bantların oluşturduğu şeritler olduğunu ve bağ dokusu tarafından bir arada tutulan çok sayıda kas lifinden (hücre) oluştuğunu gördük. Yüksek büyütmeler, bu filamentlerin, aralarında sitoplazmada mitokondrilerin yer aldığı 1-2 inç çapında birçok ince miyofibrille dolu olduğunu ortaya çıkardı. Miyofibriller ayrıca bir parçası oldukları kaslarla aynı çizgili yapıyı gösterirler. Çok geniş açık bantlar ve koyu bantlar dönüşümlü olarak yerleştirilmiştir. Açık renkli bantlara I bantları, koyu renkli bantlara A bantları denir.Her karanlığın ortasında A bandının geri kalanından daha açık renkli bir bant bulunur; Ancak I bantlarının daha koyu bir alanı vardır ki buna H tonu denir.Açık bant I’in ortasındaki çok koyu çizgi Z bandı olarak adlandırılır.Bir Z bandından diğerine uzanan tüm alan sarkomer denir. Sarcoinler, kas kasılmasının fonksiyonel birimleridir.
İskelet kaslarının karakteristik hatları, fonksiyonel kasılma birimlerinin yapısal bir yansıması olabilir mi? Farklı sonuçlara göre, evet. Kimyasal analizler, miyozinin A bantlarında ve aktinin I bantlarında yoğunlaştığını gösterdi.Ayrıca Cambridge Üniversitesi’nden A.F. Huxley, 1954’te bantların nispi genişliğinin tendonların kasılmasıyla değiştiğini gösterdi: ve H-bölgeleri daralır; Ama fark biraz farklı. Sonuç olarak, A alanları birleşir.
AF Huxley, yüksek güçlü bir ışık mikroskobu altında deneylerini yürütürken, o sırada University College London’dan H.E. Hem kalın hem de ince olan bu iplikler çok ince bir desende düzenlenmiştir. Daha kalın olan iki tanesi sadece A bantlarında bulunur ve daha ince olanlar esas olarak I bantlarında bulunur; Ancak biraz uzun bir şekilde A bantlarında yer alırlar. Bu dağılım, A, I ve H bantlarının farklı şekillerini açıklamaktadır.Her koyu renkli bant, tam olarak tek bir kalın filaman bölgesinin uzunluğudur; Kalın ve ince filamentlerin üst üste bindiği uç bölgeler daha koyu ve sadece kalın filamentlerin bulunduğu orta bölge veya H-bölgesi daha açık renklidir. Her I bandı, yalnızca ince filamentlerden oluşan bir alana karşılık gelir. Z çizgisi, ince ipliklerin tam ortadan tutturulduğu ve kasılma sırasında ince ipliklerin çekme kuvvetlerini bu yapıya uyguladıkları bir yapıdır. Bu bandın işlevlerinden biri de iplikleri doğru sırada tutmaktır. Aktin filamentlerini Z kuşağına bağlayan proteine alfa-aktin denir. Desmin olarak bilinen başka bir protein de aktini doğru pozisyonda tutar.
Huxley’ler bağımsız olarak gözlemlerinin bir sonucu olarak yeni bir kas kasılması teorisi önerdiler. Buna göre iplikler katlanmak yerine üst üste kayarak birbirine dolandı.
Teller birlikte kayarsa, kalın ve ince tellerin üst üste binme alanı, A bandının her iki ucundaki I bantlarındaki ince teller üst üste binene ve hafifçe örtüşene kadar genişleyecektir. Bu dönüşüm H bölgesinin genişliğini azaltacak ve ince filamentler birbirine değerse bu bölge tamamen kaybolacaktır. Birlikte kaydırma aynı zamanda Z çizgilerini birbirine yaklaştırarak I bantlarının genişliğini büyük ölçüde azaltır, ancak A bantlarının genişliği biraz değişecektir; Çünkü bu bantlar, değişmeyen (aşırı çekme durumunda Z çizgileri ile temas sonucu belki hafif bir çekme dışında) kalın filamentlerin uzunluğuna karşılık gelir. Böylece transformasyon teorisi sarkomlarda gözlenen değişiklikleri açıklamaktadır. Ancak kaymanın nasıl meydana geldiği keşfedilmeyi bekliyor.
Kalın filamentler miyosinden oluşur ve ince filamentler esas olarak aktinden oluşur. Kalın miyozin lifleri ile daha ince aktin lifleri arasında bir tür bağlantı olmalı ve elektron mikroskobu görüntüleri aralarında küçük çapraz köprüler gösteriyor. Sonuçlar, bunların kalın lif parçaları olduğunu kanıtlıyor. Kalın iplik, bir miyozin molekül demeti gibidir. Bu moleküllerin her biri uzun bir kuyruk ve bir çift küresel kafadan oluşur. Miyozin molekülü proteolitik enzimler tarafından parçalanırsa, baş bölgeleri açıkça aktine bağlanan ve ATP’yi hidrolize eden miyozindir. Bu, bunların çapraz köprüler olduğunun güçlü bir göstergesidir.
Huxley’in kayan filament teorisine göre, çapraz köprüler, miyozin filamentlerinin aktin filamentlerini çekmesine izin veren kancalar veya kaldıraçlar gibi davranır. Çapraz köprüler, özel reseptör bölgelerinde aktine doğru eğilir ve bağlanır. Sonra aktini de çekerek diğer yöne bükülürler. Daha sonra aktini serbest bırakırlar, başlangıçta büküldükleri yönde yeniden bükülürler, aktine yeni bir aktif bölgede bağlanırlar ve onu geri çekerler. Diğer bir deyişle, ipliklerin kayma hareketi tek yönlü bir tekerlek mekanizması ile gerçekleştirilir. Gerekli enerji, ATP’nin miyozin tarafından hidrolizi ile sağlanır. Düz kas hücreleri, çizgili kas hücrelerinin filaman düzeninden yoksun olsa da, sonuçlar bu hücrelerin de aynı mekanizma ile kasıldığını göstermektedir.
kaynak:
https://www.sciencedirect.com
yazar: bronzlaştırıcı tonik
Diğer gönderilerimize göz at
[wpcin-random-posts]