Malzemelerin genel yapılarını koruyan molekülleri oluşturan atomlar arasındaki çekim kuvvetidir. Bu kuvveti (kimyasal bağ) ortadan kaldırmak için kimyasal bir işlem gereklidir. Maddelerin atomlarının oluşturduğu moleküller arası çekim kuvveti daha zayıftır. Maddelerin katı, sıvı ve gaz gibi farklı fiziksel hallerde olabilmesinin nedeni, bu çekim kuvvetinin farklı büyüklüklerde olmasıdır. (Bu makalede, hal aşkınlığı yoluyla ani bir değişimi ifade eden maddenin “plazma” hali, süblimleşme ve buz çözme ele alınmamıştır.)
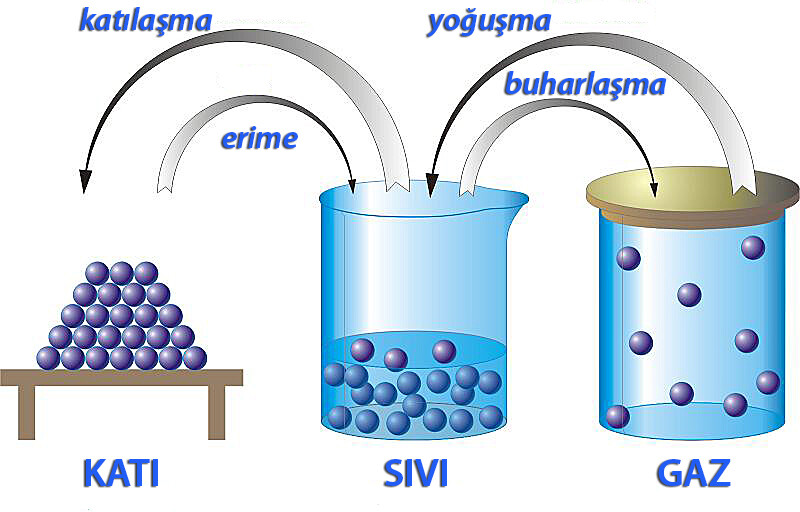
Maddenin hal değiştirmesi
Herhangi bir maddenin tanecikleri arasındaki mesafenin boyutu, tanecikler arasındaki çekim kuvvetinin büyüklüğünü etkiler. Bir maddenin molekülleri arasındaki boşluğu artırmak, bu çekici kuvveti zayıflatır. Ayrıca tanecikleri birbirine çok yakın ve dolayısıyla katı halde olan bir maddenin tanecikleri arasındaki çekim kuvveti de çok yüksektir.
Isıtılan katının türbülansı artar yani taneciklerinin kinetik enerjisi artar ve tanecikler birbirinden uzaklaşmaya başlar. Tanecikler arasındaki çekim kuvveti zayıflar ve katının durumu sıvı hale geçer. Sıvılaşan malzeme ısıtılmaya devam edilirse moleküllerinin hareketi artar ve birbirlerinden uzaklaşmaya devam ederler. Böylece tanecikleri yerçekimi kuvvetiyle yok olacak kadar zayıflamış olan sıvı haldeki madde, tekrar hal değiştirerek gaz halini alır.
Moleküller arasındaki bağların kırılması
Katıların molekülleri arasındaki boşluklar, sıvıların ve gazlarınkinden çok daha küçüktür. Bu nedenle, katı parçacıkların hareketi sınırlıdır. Katıların molekülleri sadece “titreşim” hareketine sahipken, sıvılar ve gazlar hem “titreşim” hem de “öteleme” hareketine sahiptir. Maddenin sıcaklığının artmasıyla moleküllerinin termal enerjisi ve titreşimi artar ve yavaş yavaş “erime” ve “buharlaşma” olayları meydana gelir:
– çöküş:
Termal enerjisi ve moleküllerin hareketliliği artan bir katının molekülleri arasındaki bağlar zayıflar ve kısmen kırılır, atomlar daha serbest hareket eder ve madde eriyerek sıvı hale gelir.
– buharlaşma:
Sıvı haldeki madde ısı almaya devam ederse moleküller arasındaki bağlar tamamen kopar ve tanecikler çok hızlı hareket etmeye başlar ve bir arada kalamazlar. Buharlaşma, bir maddenin gaz haline geçmesiyle gerçekleşir.
Erime ve buharlaşma sırasında ortamdan ısı alındığı için ortamın sıcaklığı da düşer. Günlük hayatta buharlaşmanın bu özelliği soğutma amaçlı kullanılmaktadır.
Moleküller arasında bağlar oluşturun
Erime ve buharlaşma gibi zıt olaylar gerçekleştiğinde, yani yoğunlaşma ve donma, maddelerin molekülleri arasındaki çekim güçlenir ve bağlar yeniden oluşmaya başlar. Parçacıkların hareketi yavaşlar ve bir faz değişimi meydana gelir:
– Konsantrasyon:
Gaz halindeki bir madde ısı kaybettiğinde sıvı hale geçmeye başlar. Kinetik enerjisi azalan tanecikler birbirine yaklaştıkça aralarındaki çekim kuvveti artar, tanecikler arasında bağlar oluşur ve madde sıvı hale gelir.
Donmak
Sıvı bir madde ısı kaybettiğinde katı hale geçmeye başlar. Molekülleri yavaş hareket eder ve aralarında bağlar oluşur. Donmuş maddenin hacminde de bir değişiklik vardır. Dondurulmuş ürünlerin hacmi genellikle azalırken, bazı ürünlerin ve suyun hacmi artar. Bu nedenle soğuk havalarda su borularında çatlaklar oluşur.
Yoğuşma ve donma sırasında ortama ısı akarken ortamın sıcaklığı yükselir.
Erime ve donma sıcaklıkları
Her madde ancak belli bir sıcaklık değerine ulaştığında erimeye başlar ve bu değer erime sonuna kadar (saf maddelerde) sabit kalır. Söz konusu değer bir termometre ile ölçülebilir ve değişmeden görülebilir. Bir maddenin erimeye başladığı sıcaklık değerine “erime noktası” veya “erime noktası” denir. Özgül ısı gibi, füzyon ısısı da maddeleri karakterize etmek için kullanılan bir özelliktir ve “Le” harfi ile gösterilir. Erime ısısının birimi joule/gram (J/g) veya kcal/gram’dır (kcal/g). Örneğin, kurşunun erime ısısı 24,5 J/g, gümüş 88,2 J/g, altın 64,4 J/g ve bakır 134 J/g’dir. Bir maddeyi erime noktasında tamamen eritmek için gereken ısı
x (ısı) = m (kütle). Le (erime sıcaklığı)
Bağıntı ile hesaplanır.
Her sıvı madde ancak belli bir ısı değeri kaybettiğinde donmaya başlar. Bir sıvıdan katı hale geçmek için verilmesi gereken ısıya “donma ısısı” denir. Erime sıcaklığı gibi donma sıcaklığı da karakteristiktir. Bir maddenin donma noktası erime noktasına eşittir. Donma sıcaklığı “Ld” ile gösterilir. Donma sıcaklığındaki bir maddenin tamamen donması için gereken ısı
x = m LD (donma sıcaklığı)
Bağıntı ile hesaplanır.
Malzemelerin donma sırasında çevreye ısı verme özelliği günlük hayatta da kullanılmaktadır. Örneğin meyve ve sebzelerin haznelerine su konularak donmaları engellenir. Ayrıca bir katı, saf bir sıvı içinde çözündüğünde, o sıvının donma sıcaklığı değişir ve azalır. Örneğin tuz, suyun donma noktasını düşürdüğü için kış aylarında yollara tuz serpilerek buz oluşumu engellenir.
Daha sıcak yoğuşma ve buharlaşma
1 gram gaz halindeki bir maddenin yoğuşması için ortama verilmesi gereken ısıya “yoğuşma ısısı” denir. Bir maddenin yoğunlaşma ısısı ile buharlaşma ısısı birbirine eşittir.
Bir gram sıvı maddenin buharlaşması için gereken ısıya “buharlaşma ısısı” denir. Bu, malzemenin tanımlayıcı bir özelliğidir ve “Lb” ile gösterilir. Kurşunun buharlaşma ısısı 870 J/g, altın 158 J/g, gümüş 233 J/g ve bakır 506 J/g’dir. Buharlaşma ısısı, bir maddenin belirli bir miktarını buharlaştırmak için gereken ısıdır.
x = m pound
Bağıntı ile hesaplanır.
Buharlaşma için gereken ısı, buharlaşma ısısına ve maddenin kütlesine bağlıdır. Eşit kütleli maddeler için, buharlaşma ısısı ne kadar yüksekse, buharlaşma için o kadar fazla ısıya ihtiyaç vardır.
Isınma ve soğuma çizelgeleri
Örneğin buz ısıtıldığında sıcaklığı yükselmeye başlar ve bir süre sonra sıcaklığı erime noktasına ulaştığında erimeye başlar. Isı devam ettikçe tüm buzlar erir ve sıvı hale gelir. Isıtmaya devam edilirse sıvı bir süre sonra kaynayacak ve son aşamada buharlaşmaya başlayacaktır. Termometre ile ölçülen ve kaydedilen süreçteki olayların sıcaklık değerleri ve belirli zaman dilimlerinde maddede meydana gelen değişimler bir tabloya aktarılıp grafiksel olarak gösterilebilir. Bu tür grafiklere “bir maddenin ısınma eğrisi” (“soğutulursa soğuma eğrisi”) denir.
kaynak:
-David L. Goodstein, “Maddenin Halleri”, Dover Books on Physics, Dover Publications.
yazar: Juni Saraoğlu’nu aç
Diğer gönderilerimize göz at
[wpcin-random-posts]