İçindekiler
Tükürük sindirimi
İnsan sindirim sisteminde, gıdanın ağızdan anüse kadar karmaşık tübüler sistemden geçmesi sırasında meydana gelen kimyasal değişiklikler çok önemlidir. Enzimatik sindirim ağızda başlar. Tükürükte nişastanın glikoza hidrolizi başlar. Ancak eksik olan amilaz (ptyalin olarak da bilinir) adı verilen bir enzim vardır. Nişasta, suyu serbest bırakan yoğuşma reaksiyonları yoluyla sentezlenir. Bu nedenle ayrışmaları da hidroliz gerektirir. Amilaz bir miktar glikoz oluştursa da, daha fazla maltoz, disakkarit ve bağırsakta daha fazla sindirilmesi gereken üç ila dört glikoz biriminden daha az parça salar.
Besin ağızda kısa süre kaldığı için amilazın etkisini göstermesi için yeterli fırsat yoktur. Başlıca etkisi, bolusun yutulup mideye iletilmesinden sonra ortaya çıkar. Ancak mide asidi kısa bir süre sonra bu enzimi etkisiz hale getirir, bu nedenle tükürük amilazı gıdadaki nişastanın ancak küçük bir yüzdesini sindirebilir. Aslında birçok memelinin tükürüğü amilaz içermez. Örneğin, köpekler ve akrabalarının diyetlerinde o kadar az nişasta vardır ki, nişasta sindiren enzimin gelişmesi için çok az seçilim baskısı olmalıdır.
midede sindirim;
Yiyecek mideye ulaştığında, mide duvarının mukoza zarındaki çok sayıda bez tarafından salgılanan mide suyunun etkisiyle karşılaşır. Bu sıvı, büyük miktarda hidroklorik asit ve çeşitli enzimler içerir. Asit, mide içeriğinin pH’ını oldukça asidik hale getirir (pH 1.5-2.5 civarında). Birçok ilaç reklamında aksi belirtilmekle birlikte, midedeki asitlik normaldir ve normal çalışması için gereklidir. Mide suyunun ana enzimi, proteinleri sindiren pepsindir. Birçok proteolitik (protein parçalayıcı) enzimin aksine, yalnızca yüksek oranda asidik ortamlarda çalışır. Pepsin, omurgalıların karakteristik bir enzimidir. Çoğu omurgasız, güçlü asit çözeltilerinde işlev gören proteolitik enzimlerden yoksundur. Pepsi’nin evrimi, kemikli hayvanların beslenmesiyle ilgili olabilir. Çünkü kemikler asitte daha kolay parçalanır. Pepsin, proteini amino asit bileşenlerine hidrolize etmez. Başta tirozin ve fenilalanin olmak üzere birkaç amino aside bitişik peptit bağlarını koparır. Proteolitik enzimlerin özgüllüğü kolayca anlaşılabilir. Proteinlerin yapı taşları olan bileşikler çeşitli olduğundan, farklı peptit bağlarının etrafındaki yapısal düzenleme, bu bağları bağlayan iki amino asit tipine bağlı olarak değişir. Bazı bağlar enzimin aktif merkezinde bulunur, bazıları değildir. Örneğin, pepsinde peptit bağları, aktif merkezde R grupları bulunan altı karbonlu bir halka içeren amino asitlerin amin ucunda bulunur.
Protein sindirimi denilince akla hemen şu soru gelir: Sindirim kanalının duvarı, esasen proteinden oluşmasına rağmen neden proteolitik bir enzimle sindirilmez? Bunun iki nedeni var.
İlk olarak, sindirim sisteminin duvarı mukus ile kaplanır ve böylece enzimlerden korunur. Bu savunma hattı kırıldığında sindirim enzimleri iç yüzeyin küçük bir bölümünü sindirmeye başlar; Ortaya çıkan yaraya ülser denir. Bazen ülser o kadar ciddi hale gelir ki, sindirim sisteminin duvarında bir delik oluşur ve kanalın içeriği karın boşluğuna dökülür. Çoğu ülsere belirli bir bakteri türü neden olur.
İkincisi, mide bezleri aktif pepsin değil, aktif olmayan bir öncü olan pepsinojen salgılar. Bu inaktif enzimlere öncü zimojenler denir. Pepsinojenin enzimatik aktivitesi yoktur ve mide duvarındaki bezlerde tutulduğu sürece duvara zarar vermez. İhtiyaç duyulana kadar burada tutulur ve ancak midede bulunan aktif pepsin ile temas ettiğinde aktif hale gelir. Aktivasyon, 42 amino asidin pepsinojenin bir ucundan uzaklaştırılmasıyla gerçekleşir; Kalan en kısa peptit zinciri pepsindir.
İnce bağırsakta sindirim
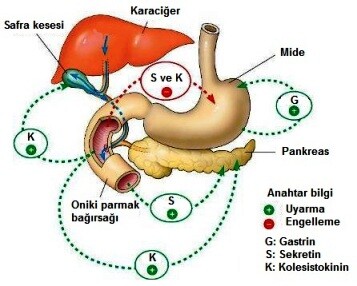
Sindirimin çoğu, sindirim sisteminin bir sonraki bölümünde, yani ince bağırsakta gerçekleşir. Kısmen sindirilen besinler mideden duodenuma yani duodenuma geçtiğinde asitliği nedeniyle bağırsakta (lümen) birçok farklı enzimin salgılanmasını uyarır. Bu enzimlerin iki ana kaynağı vardır: pankreas ve bağırsak bezleri. Midenin hemen altında bulunan büyük bir bez olan pankreas, sindirim sisteminin dış uzantısı olarak fetal gelişim sırasında oluşur. Onikiparmak bağırsağına olan bağlantısını korur ve bu bağlantıya pankreas kanalı denir. Gıda duodenuma girdiğinde, pankreas bir enzim karışımı salgılar ve onu pankreatik kanal yoluyla duodenuma boşaltır. Bu karışımda, her türlü temel besin maddesini (karbonhidratlar, yağlar ve proteinler) ve ayrıca nükleik asitleri sindirecek enzimler bulunur.
Pankreas enzimlerinden biri pankreatik amilazdır (bazen diyastaz veya amilopsin olarak adlandırılır) ve adından da anlaşılacağı gibi, nişastayı disakkarit maltoza parçalayarak tükürük amilazına benzer şekilde çalışır. Nişasta sindiriminin çoğunu yaptığı için tükürük amilazından daha önemlidir.
Pankreas tarafından da salgılanan lipaz, vücuttaki yağları sindiren en basit enzimdir. Ancak nispeten küçük bir yağ yüzdesini tamamen gliserol ve yağ asitlerine ayırır. Bazı yağlar kısmen sindirilir, üç yağ asidinden yalnızca biri çıkarılır, bazıları ise hiç sindirilmez. Bununla birlikte, yağlar ve kısmi ayrışma ürünleri, yağda çözündükleri için hücre zarlarından emilebilirler.
Pepsin gibi, pankreatik proteolitik enzimler, tripsin ve kimotripsin, yalnızca belirli amino asitlerin komşu peptit bağlarını kırar. Tripsin, lizin ve argininin komşu peptit bağlarını (her ikisi de pozitif yüklü R gruplarına sahiptir. Kimotripsin, tirozin, fenilalanin ve triptofan (R grupları altı karbon halkasına sahiptir) ve daha az ölçüde metiyonin ve lösin komşularını kırar. Kimotripsin benzer olsa da) Bağların hidrolizi açısından pepsin, bu iki enzim aynı bağları kırmadığı için benzerlik yüzeyseldir.
Pepsin, tirozin ve fenilalaninin amino ucundaki bağları, kimotripsin ise karboksilat tarafındaki bağları koparır.
Yine pepsin gibi, hem tripsin hem de kimotripsin, sırasıyla tripsinojen ve kimotripsinojen olarak adlandırılan inaktif formlarda (zimojen) salgılanır. Bağırsakta, tripsinojen, bağırsak bezleri tarafından salgılanan bir enzim olan enterokinaz tarafından (polipeptit zincirinden altı amino asit çıkarılarak) aktif tripsine dönüştürülür.
Tripsin oluşumu bu şekilde daha sonra kimotripsinojen polipeptit zincirinin iki küçük iç parçasını çıkarır. Kalan aktif kimotripsin, disülfit bağları ile bağlanan üç ayrı polipeptit zincirinden oluşur. Gördüğünüz gibi, şimdiye kadar bahsettiğimiz polipeptit zincirleri, aktif enzimlerin zincirlerinden daha uzundur. Üçü için de, zincirin bir veya daha fazla bölümünün kesilmesiyle aktivasyon gerçekleşir. Böylece polipeptit, aktif bir bölge oluşturmak için yeniden katlanabilir.
Tripsin ve kimotripsinin kimyasal yapıları üzerine yapılan son araştırmalar, hem potansiyel gelişimin hem de katalitik özgüllüğün temelinin daha iyi anlaşılmasına yardımcı olmuştur.
Bu iki enzim arasındaki amino asit dizileri, katlanma düzeni ve hatta katalitik bölgelerdeki benzerlikler, bunların aynı proteolitik ata enzimden evrimleştiğini düşündürür. Ancak ikisi arasında küçük; Ama çok önemli bir fark var. Bu fark, substrat amino asidinin R grubunu bağlayan bağlanma bölgesinin cep benzeri bir bölgesi ile ilişkilidir. Tripsinde bu bölgeyi oluşturan amino asitlerden biri aspartik asittir (negatif yüklü bir R grubuna sahiptir). Kimotripsinde serin aynı pozisyonda bulunur (R grubu yüksüzdür). Görünüşte küçük olan bu fark, iki enzimin farklı amino asit afiniteleri göstermesine neden olur. Bu durum (primer yapı) amino asit dizisinin enzimlerin fonksiyonel özelliklerini belirlemede ne kadar önemli olduğunu çarpıcı bir şekilde göstermektedir.
Özetle, mide pepsin ve pankreasın tripsin ve kimotripsin etkisiyle proteinler farklı uzunluklarda fragmanlara ayrılır; Ancak pek çok serbest amino asit salınmaz. Bu üç enzim endopeptidazlar olarak bilinir. Bu, terminal amino asitleri ana zincire bağlayan enzimler değil, proteinin içindeki peptit bağlarını kıran enzimler oldukları anlamına gelir. Başka bir enzim sınıfı olan ekzopeptidazlar, endopeptidazların aktivitesiyle üretilen fragmanlardaki terminal amino asitleri parçalayarak sindirim sürecini tamamlar. Ekzopeptidazlar geniş bir çeşitlilik gösterir ve her birinin etkisi oldukça spesifiktir. Örneğin bunlardan biri (karboksipeptidaz), zincirin serbest karboksil ucundaki amino asidi birbirine bağlayan bağı hidrolize eder. Başka bir (aminopeptidaz), amino asidi serbest amino ucunda bağlayan bağı hidrolize eder. Diğerleri (dipeptidazlar), amino asit çiftleri arasındaki bağları kırar. Biri sadece glisin ve lösin çifti arasındaki bağı koparırken, diğeri iki glisin molekülü çiftindeki bağı koparır. Bu ekzopeptidazlar, endopeptidazlar tarafından başlatılan eylemi tamamlar. Bunların çoğu sindirim kanalındaki bezler tarafından salgılanır. Ancak karboksipeptidaz pankreasta yapılır.
Çeşitli proteolitik enzimlerin kimyasal etkilerinin bu kadar uzun süre açıklanmış olmasının nedeni, hangi enzimin hangi bağı hidrolize ettiğini hatırlamanın önemli olması değil, proteolitik mekanizmanın enzim özgüllüğüne ve enzimlerin bir takım olarak nasıl çalıştığına güzel bir örnek olmasıdır. Basitçe proteinlerin pepsin, tripsin ve diğer çeşitli peptidler tarafından sindirildiğini söyleseydik, bu görünüşte sıradan olaylarda tam etkileşimin ne olduğu hakkında hiçbir fikriniz olmazdı.
Bağırsak bezlerinden salgılanan bazı enzimler nasıl proteinlerin sindirimini tamamlıyorsa, diğer bağırsak enzimleri de tükrük ve pankreatik amilazın başlattığı nişasta sindirimini tamamlar. Amilazlar esas olarak nişasta moleküllerini disakkaritlere ayırır.
Bağırsak enzimleri şekerleri basit şekerlere ayırır. Örneğin maltaz, maltozu, sükrozu ve laktoz intoleransını parçalar.
Nükleik asitler de benzer şekilde sindirilir. Pankreastan salgılanan eksonükleazlar, nükleik asitleri nükleotidlere ayırır. Nükleotitler daha sonra bağırsak bezlerinden salgılanan fosfatazlar (fosfat bağlarını kıran) ve N-glikozilazlar (ribozu parçalayan) tarafından sindirilir.
Sindirim ürünlerinin emilmesi, beklediğiniz gibi aktif taşıma gerektirir. Son yıllarda, amino asitlerin ve basit şekerlerin ‘pompaları’ üzerine yapılan araştırmalar, her ikisinin de hücre zarının iki tarafı arasındaki (Na+) gradyanına bağlı olduğunu göstermiştir. Burada hücre dışındaki Na konsantrasyonu yüksek, hücre içindeki Na konsantrasyonu ise düşük olmalıdır. Bu nedenle, bu aktif taşıma pompalarının sodyum-potasyum pompasıyla ilişkili olduğu görülmektedir.
mahsul
İnsan sindirimi çalışmasında, başka bir boşaltımdan söz edilmelidir. Çok önemli bir organ olan karaciğer, yağların sindirimine yardımcı olan safra adı verilen bir sıvı üretir. Karaciğer çok büyüktür ve üst karın boşluğunun çoğunu kaplar. Yüzeyinde küçük bir depolama organı olan safra kesesi bulunur. Karaciğerde sentezlenen tüm safra, bir dizi dallanma kanalı tarafından toplanır ve safra kesesine boşaltılır. Gıda duodenuma girdiğinde, safra kesesinin kas duvarı kasılmak üzere uyarılır, böylece safra safra kanalından duodenuma akmaya zorlanır.
Safra bir sindirim enzimi değildir. Bir protein bile değil. Tuzların, pigmentlerin ve kolesterolün karmaşık bir çözeltisidir. Safra tuzları, büyük yağ damlacıklarının suda asılı kalan daha küçük damlacıklara dönüşmesine izin vererek emülsifiye edici maddeler olarak işlev görür. Bu etki bir deterjanınkine çok benzer. Lipazın sindirim eylemi için birçok küçük yağ damlacığı tarafından oluşturulan yüzey alanı, birkaç büyük damlacıktan daha büyük olacaktır. Safra tuzları da yağların emilmesine yardımcı olur. Bağırsakta safra tuzları yetersiz ise yağların hem sindirimi hem de emilimi ciddi şekilde bozulur. Safra tuzları kalın bağırsak tarafından emilir, daha sonra karaciğere taşınır ve tekrar kullanılır. Safra pigmentleri ve kolesterolün sindirimde rolü yoktur. Pigmentler, karaciğerdeki kırmızı kan hücrelerinin yıkımı sonucu oluşur ve dışkıya kendine özgü kahverengi rengini verir. Nispeten çözünmeyen bir bileşik olan kolesterol, bazen sert safra taşları oluşturarak sorunlara neden olur. Çünkü safra taşları safra kanalını tıkayabilir ve safra akışını engelleyebilir.
kaynak:
https://www.sciencedirect.com
yazar: bronzlaştırıcı tonik
Diğer gönderilerimize göz at
[wpcin-random-posts]