yıllardır kanser tedavileri Ameliyat, kemoterapi ve radyoterapiye bağımlıydı. İmatinib ve trastuzumab gibi ilaçlar sadece kanser hücrelerini hedef alır. Son yıllarda geliştirilen bir immünoterapi yaklaşımına adaptif hücre transferi (ACT) adı verilir. Hastanın bağışıklık sistemi, kanseri tedavi etmek için hücreleri kullanır. Birkaç ACT türü vardır, ancak bunlar arasında yalnızca CAR-pozitif T-hücre tedavisi klinik aşamaya ulaşmıştır.
Bugüne kadar, kimerik antijen reseptörü T hücre tedavisinin kullanımı, ilerlemiş lösemili hastalarda kullanıma yönelik küçük klinik denemelerle sınırlandırılmıştır. Ancak bu tedaviler araştırmacıların dikkatini çekmiştir. Çünkü bu tedavi ile tedavi edilen yetişkinlerde ve çocuklarda belirgin bir iyileşme gözlendi.
2017 yılında ABD Gıda ve İlaç İdaresi tarafından iki CAR T hücre tedavisi onaylandı. Biri pediatrik akut lenfoblastik lösemiyi (ALL) tedavi etmek, diğeri ise erişkin ileri lenfoma tedavisidir. Ancak araştırmacılar, CAR T-hücresi tedavilerinin henüz başlangıç aşamasında olduğunu söylüyor. Bu tür bir tedavinin meme ve kolon kanseri gibi katı tümörlerin tedavisinde etkili olup olmadığı henüz bilinmiyor.
Çeşitli ACT biçimleri hala geliştirilmektedir. Ancak yıllarca süren sıkı çalışmanın ardından, ayar noktasına ulaşıldı. Son birkaç yılda, CaR T hücre tedavisi ve diğer ACT yaklaşımları hızla artmıştır. Araştırmacılar, bu tedavilerin hastalarda nasıl çalıştığı ve nasıl geliştirilip test edileceği konusunda ilerleme kaydetti. Ancak önümüzdeki birkaç yıl içinde bu tür tedaviler hızla yaygınlaşacaktır.
İçindekiler
Canlı tıp
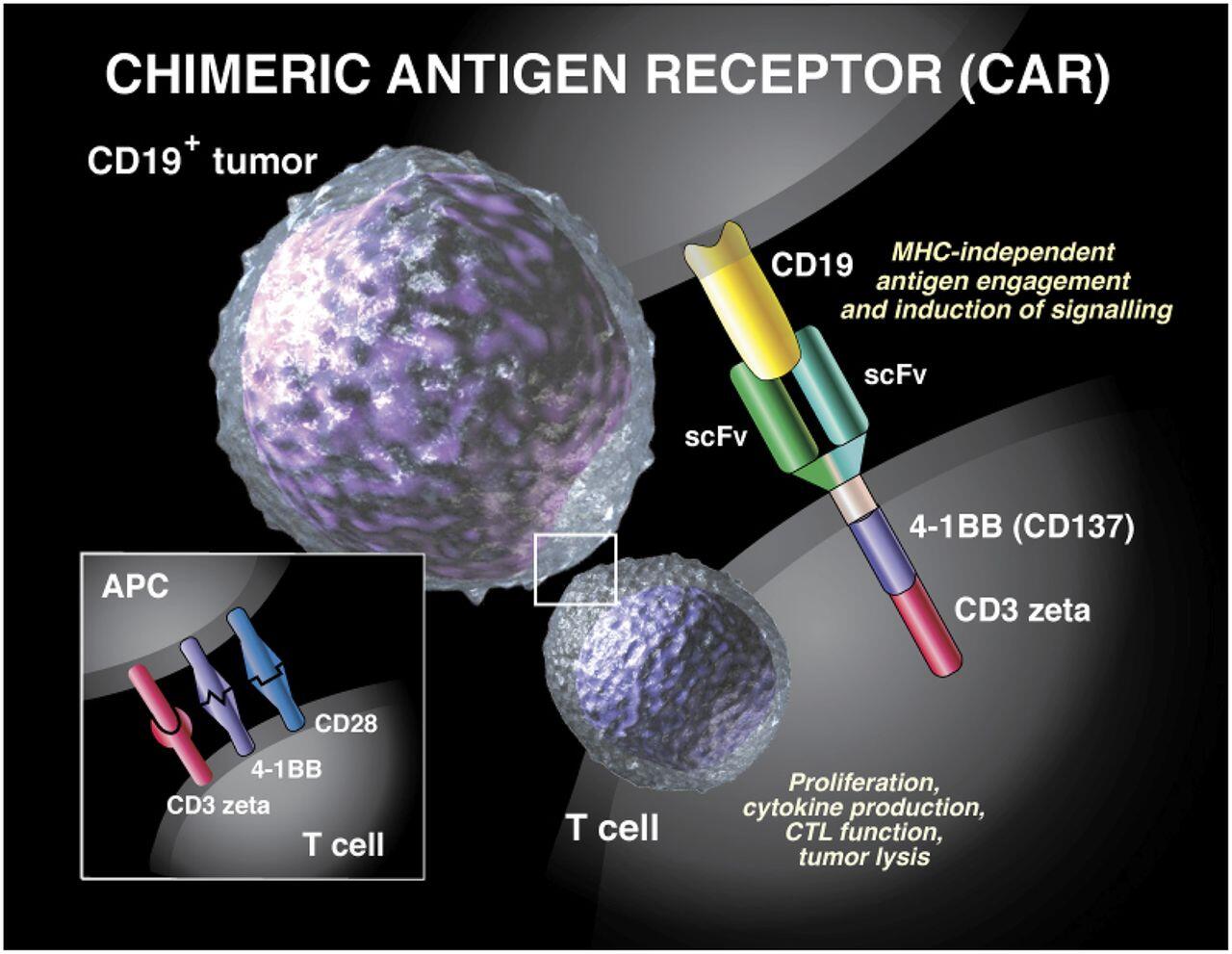
CAR T-hücre tedavisinin omurgası, bağışıklık sistemi tepkisini aktive eden ve enfekte olmuş hücreleri öldüren T hücreleridir. Bu tedavide hastanın kanı alınır ve T hücreleri ayrıştırılır. Bir sonraki adımda, T hücreleri zararsız bir virüsle genetik olarak modifiye edilir ve yüzeylerinde kimerik antijen reseptörleri adı verilen CAR reseptörleri üretir. Bu reseptörler, doğal olarak oluşmayan sentetik moleküllerdir.
Özel reseptörler, T hücrelerinin belirli bir proteini tanımasını ve yok edilecek hücreye bağlanmasını sağlar. CAR T hücresi terapileri, B hücreleri üzerindeki CD19 antijenini (bir protein) hedefler. T hücreleri kümelendiğinde, in vitro olarak milyonlarca hücre olarak üretilen antijene özgü bir CAR üretirler.
Son aşama ise CAR T hücrelerinin hastaya transferidir. Her şey planlandığı gibi giderse T hücreleri hastanın vücudunda çoğalmaya devam edecek ve sentetik alıcının rehberliğinde kanser hücrelerini öldürecektir.
Çeşitli CAR T-hücre terapileri geliştirilmekte ve klinik deneylerde test edilmektedir. Terapi türleri arasında farklılıklar olsa da hepsi benzer içerikler taşır. Hücre yüzeyindeki CAR, sentetik antikorların parçalarından veya alanlarından (alanlarından) oluşur. Kullanılan alanlar, reseptörün tümör hücresindeki antijeni ne kadar iyi tanıyabildiğini veya ona bağlanabildiğini etkiler.
CAR-T hücre tedavisinin ilk gelişimi, çocuklarda en yaygın kanser türü olan ALL’ye odaklandı. B hücre kaynaklı ALL teşhisi konan çocukların %80’i yoğun kemoterapi ile tedavi edildi. Ancak bir kök hücre nakli veya kemoterapiden sonra, nükseden kanser için herhangi bir tedavi seçeneği yoktu. Tekrarlayan ALL, pediatrik kanserlerde en yaygın ölüm nedeniydi.
Dr. Grupp, kanseri nüks eden veya mevcut tedavilere yanıt vermeyen ALL’li genç erişkinlerde ve çocuklarda CAR T hücreleriyle birkaç deney yaptı. Bir ön deney, CD19 reseptörüne bağlanan CAR T hücrelerini kullandı. 30 hastanın 27’sinde tüm kanser belirtileri kayboldu. Tedaviden sonra çoğu hastada kanser tekrarlamadı.
Kymriah adı verilen CD19 hedefli CAR T hücre tedavisi için, ilk başarının ardından çocuklarda ve ergenlerde daha geniş bir tedavi uygulandı. Tedaviye katılan hastaların çoğu uzun süreli iyileşme gösterdi. Sonuç olarak, Gıda ve İlaç İdaresi ilacı Ağustos 2017’de onayladı.
Bununla birlikte, lösemili yetişkinlerin tedavisi için CAR-pozitif T-hücre tedavisi ile umut verici sonuçlar olmamıştır. C19 hedefli CAR T hücre tedavisi, ALL’ye ek olarak lenfomalı hastalarda iyi sonuçlar göstermiştir.
Yan etkilerle başa çıkmak
Tüm kanser tedavilerinde olduğu gibi bu tedavide de ciddi ve potansiyel olarak ölümcül yan etkiler ortaya çıkabilir. En yaygın olanı sitokin salınım sendromudur (CRS). Bağışıklık sisteminin işleyişinin bir parçası olarak, T hücreleri sitokinler (bağışıklık sistemi tepkisini tetikleyen kimyasallar) salgılar. CRS durumunda, büyük miktarlarda sitokinler hızla kan dolaşımına salınır, bu da sıcaklıkta bir artışa ve kan basıncında hızlı bir düşüşe neden olur.
Aynı zamanda, CRS’nin ortaya çıkması, aktif T hücrelerinin vücutta çalıştığını gösterir. Genel olarak, CAR T tedavisinden önce çok hasta olan kişiler CRS yaşama eğilimindedir. Birçok hastada KRS steroidlerle tedavi edilebilir. Birkaç yıl önce şiddetli KRS’si olan hastalarda, T hücreleri ve makrofajlardan salınan yüksek düzeyde antiinflamatuar sitokin IL-6 gözlemlediler. Osteoartrit tedavisi olarak başlayan IL-6 bloke edici ilaçların kullanımı, hastalarda KRS’nin tedavisine yol açmıştır. Bu nedenle, bu tip tedavi KRS için standart hale gelmiştir.
CAR T-hücresi tedavisinin bir başka yan etkisi, daha yüksek B-hücresi ölümü oranıdır. Normal B hücrelerinde, CD19 antijeni, antikor üretiminden sorumludur. Normal B hücreleri, CAR T hücreleri tarafından öldürülür. Bu hasarı telafi etmek için hastanın immünoglobulin tedavisi alması gerekir.
CAR-T hücre tedavisi geliştirme çalışmaları devam etmektedir. Bu çalışmalardan bazıları; CAR T hücrelerinin nanoteknoloji kullanılarak vücutta büyütülmesi ve CRS benzeri yan etkilerin önlenmesi için yapılan çalışmalardır. Mevcut CAR T tedavi yöntemini geliştirmek için yapılacak daha çok iş var.
kaynak:
https://www.cancer.gov/about-cancer/tedavi/research/car-t-cells
yazar: Ayka Olkay
Diğer gönderilerimize göz at
[wpcin-random-posts]