Preklinik testler için, klinik testlerin başarısı için öngörülebilirlik kritik öneme sahiptir. Bugün yapılan klinik öncesi testler; Etkinlik, toksisite ve farmakokinetik açısından mükemmel olmaktan uzaktır. Hayvan modelleri altın standart olarak kabul edilirken, laboratuvar hayvanlarının kullanımı etik soruları gündeme getirmektedir. Ek olarak, hayvan türleri ilaca oldukça duyarlıdır. Bu nedenle, klinik öncesi tahminlerin doğruluğu azalır. Enfeksiyon gibi hastalıklar için hayvan modeli yoktur. Hayvan modellerinde test edilen kanser ilaçlarının sadece yüzde 8’i insan klinik deneylerinde başarıyla uygulandı. Hayvan modellerine ek olarak, klinik öncesi denemelerde iki boyutlu hücre kültürleri yaygın olarak kullanılmaktadır. Ancak, 2D hücre kültürü sonuçlarının yorumlanması zordur ve sonuçlar yanıltıcı olabilir. Çünkü iki boyutlu ortamda büyüyen hücreler çoğu zaman fonksiyonlarını kaybederler ve doku ve organlardakinden farklı görünürler. Mevcut modellerdeki tüm bu sorunlar, yeni bir modele olan ihtiyacı ortaya koymaktadır. Son yıllarda EPA, NIH ve DARPA kuruluşları, çevresel kimyasalların ve ilaçların etkilerini test etmek için insan hücre modellerini desteklemeye başladılar. DARPA özellikle kültürlenmiş hücrelerden üç boyutlu insan doku ve organları üretmek için çalışmalar başlatmıştır. Böylece, 3D kültür normal doku yapısı ve fizyolojisine benzediğinden, etkinlik test edildiğinde kimyasalların insan fizyolojisindeki etkinliğine daha çok benzeyen sonuçlar elde edilebilir. Daha yakın ve daha etkili bir fizyolojik model geliştirmek için ileri tekniklere acil ihtiyaç vardır.
Organid terimi ilk olarak yenidoğanlarda görülen tümör benzeri bir doku kitlesini tanımlamak için kullanılmıştır. Bazı durumlarda doku nakillerinde organoidler kullanılmıştır. 1980’lerde ve 1990’larda evrimsel biyoloji deneylerinde de kullanıldılar. Bu gelişmeyi embriyonik kök hücrelerin keşfi, indüklenmiş pluripotent kök hücrelerin oluşturulması, yetişkin kök hücrelerin keşfi ve birçok organda kök hücrelerin varlığının gösterilmesi izlemiştir. Bu gelişmelerin ardından organoid terimi, embriyonik kök hücrelerden, indüklenmiş pluripotent kök hücrelerden veya yetişkin kök hücrelerden türetilen 3B yapılar için kullanıldı.
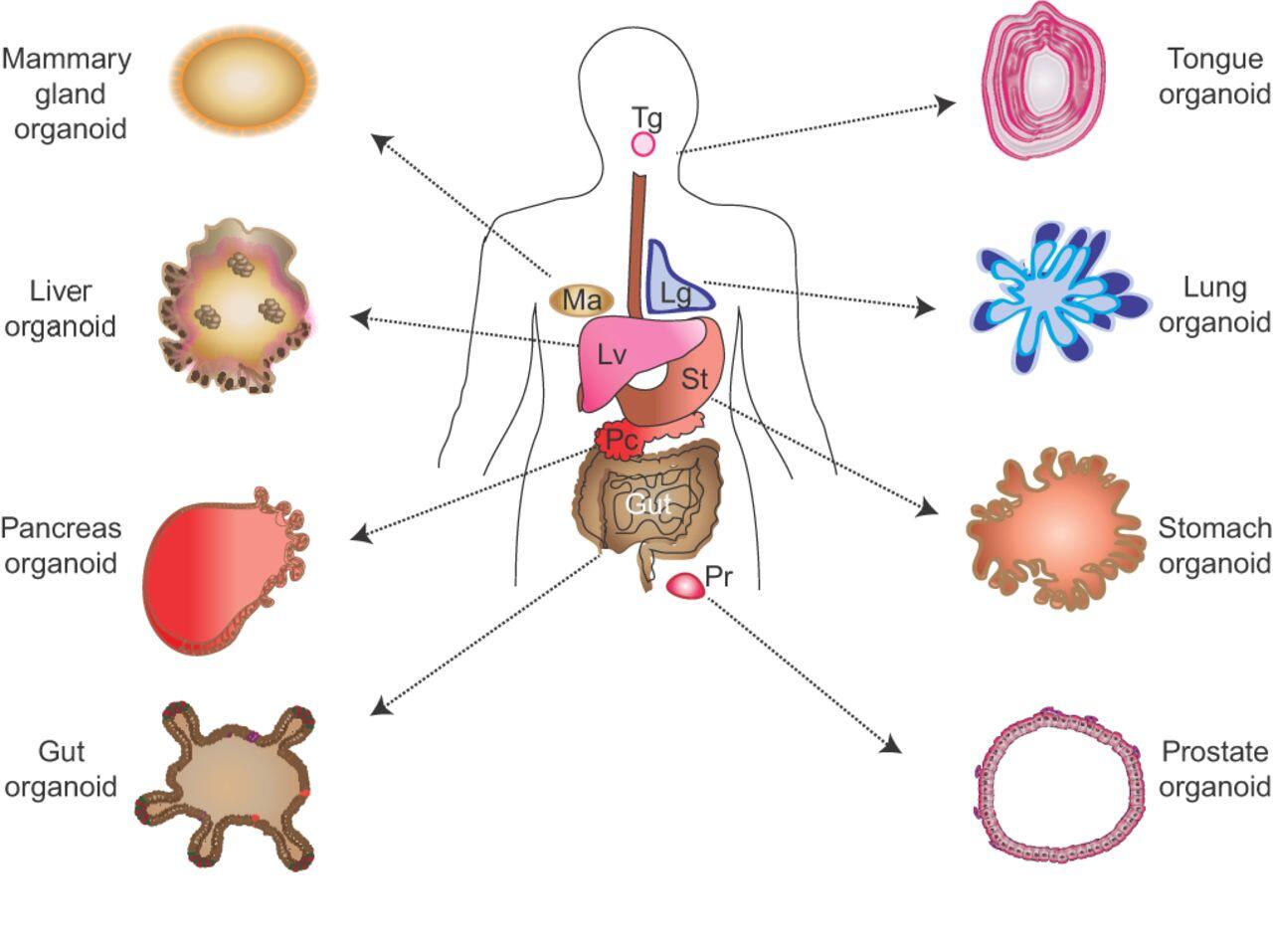
Organeller, organın türüne bağlı olarak küresel veya düzensiz şekilli olabilir. Boyutları 0,1 mm ile 1 mm arasında değişmektedir. Gen ekspresyon profili ve doku yapısında, in vivo organoidlere yüksek benzerlik gösterir. Ek olarak, in vivo organoidlere işlevsel olarak benzerler ve nakledildiklerinde hem embriyonik hem de yetişkin dokularla uyumlu olabilirler.
Günümüzde organoid araştırmalarındaki eğilimler ve zorluklar
Organoidler, kistik fibroz, polikistik böbrek hastalığı, Hirschsprung hastalığı ve mikrosefali gibi doğum kusurları gibi genetik hastalıkların patolojisini anlamak için kullanılmıştır. Helicobacter ve Zika virüsünün neden olduğu bulaşıcı hastalıkların patogenezini anlamak için organizma temelli yöntemler de kullanılmıştır. Organoid kaynaklı bağırsak ve karaciğer hücreleri rejeneratif tıp çalışmalarına kaynak olarak değerlendirilmiş ve bu hücreler birçok hayvan modelinde başarılı sonuçlar göstermiştir. Son zamanlarda, toksikoloji, hastaya özgü genetik faktörler ve onkogenezde ilaçlara yanıt araştırmaları organoidler tekniği ile yapılmaya başlanmıştır. Embriyonik kök hücreler, uyarılmış pluripotent kök hücreler ve yetişkin kök hücreler, organoid teknolojisi için sınırsız bir hücre kaynağıdır.
Üyelik teknolojisiyle ilgili birçok zorluk var. Bu güçlüklerin başında organel oluşumunun uzun ve masraflı bir süreç olmasıdır. Dahası; Canlılık, boyut ve şekil bakımından farklılıklar vardır. Çoğu durumda, bir tür organel üretme teknolojisi diğer organel türleri için geçerli olmayabilir. Örneğin, beyin organoidlerini üretme prosedürü ile karaciğer organoidlerini üretme prosedürü arasında çok az benzerlik olacaktır. Transfer tekniklerindeki bu sınırlama, organoid teknolojisinin gelişimi için büyük bir engeldir. Ek olarak, organoidlerde farklı hücre tipleri ile hücre dışı matris arasında etkileşim eksikliği vardır. Normal bir mikro ortama (hücrelerin bir arada yaşadığı ortam) sahip olması, hücrelerin birbirleriyle iletişim kurması ve işlevleri için önemlidir. Ayrıca organellerin in vitro olgunlaşma ve kültür koşulları hakkında çok az şey bilinmektedir.
Tersine mühendisliğin organoid teknolojisine uygulanması
Biyolojide tersine mühendislik, fonksiyonel benzerlik yaratmak için mevcut bir biyolojik sistemden tasarım parametrelerinin türetilmesidir. Tasarım parametreleri Hücre tipi, mikro ortam ve şekil gibi fiziksel parametreler. Organik üretimindeki bazı problemler tersine mühendislik ilkeleri ile çözülebilir.
Bu konuda yapılabilecek işlemler:
1)organik sistemlerde in vivo heterojenliği taklit eder,
2)Hücreler arası matrisin oluşumu, sertliği ve yapısı dahil olmak üzere organik mikro ortamın düzenlenmesi
3)Organizmaların in vitro olgunlaşmasının başlangıcıdır.
Organik üretim için biyomühendislik uygulamaları
Organellerdeki hücreler vücutta olduğu gibi mekanik sinyallere maruz kalmazlar. Öte yandan, dinamik kültürler sıvı basıncına ve diğer stres türlerine maruz kalabilir. Ek olarak, dinamik kültürler besinlerin ve oksijenin verimli dağılımını sağlar. Perfüzyon reaktörleri, mikroakışkan cihazlardan daha büyük ölçekte kültür üretimine izin verir. Bu reaktörler, kemik ve bağırsak dokularını tasarlamak için kullanılmıştır. Öte yandan mikroakışkan çipler de perfüzyon kültürlerinde kullanılabilir. Çip üzerinde organ, mikroakışkan bir hücre kültürü cihazıdır. Kültür ortamının ve hücrelerin aktığı küçük kanallara sahiptir. Çip üzerinde organ cihazı, bir seferde bir veya daha fazla hücrenin büyütüldüğü bir kültür olarak kullanılabilir. Doku ve organ düzeyinde patofizyolojik durumları taklit edebilir. Farmakokinetik ve toksikolojik yanıt, organ-on-a-chip kullanılarak test edilebilir. Bu sistemdeki nöronlar çoğaldığında hücrelerin çoğaldığı ve bir topluluk oluşturduğu gözlemlenmiştir. Bu sistemde mikroçevreyi ve doku olgunlaşmasını kontrol etmek için gerekli faktörlerin uygulanması da mümkündür.
Organoid tekniğin insan doku kültüründe kullanımı
Karaciğer, kalp gibi organların yetmezliği durumunda uygulanabilecek tek tedavi seçeneği organ naklidir. Bu nedenle kaliteli insan doku ve organlarına talep vardır. Amerika Birleşik Devletleri’nde 120.000, Avrupa’da 86.000 ve Çin’de 1.5 milyon kişi organ nakli bekliyor. Bu nedenle, Amerika Birleşik Devletleri’nde pluripotent kök hücrelerden indüklenen insan embriyonik kök hücreleri, kalp hücreleri ve retinal hücrelere ilişkin klinik araştırmalar yürütülmektedir. Hastadan alınan hücrelerden elde edilen iPS hücrelerinden oluşan organoidler, bağışıklık sistemi tepkisine maruz kalmayacakları için mevcut nakil yöntemlerine göre daha avantajlıdır. Bu konuda böbrek, karaciğer ve pankreas ile ilgili klinik çalışmalara da acil ihtiyaç vardır. Karaciğer ve diğer organiklerin kullanılmasındaki sorun, bunların gerekli boyutta olamamasıdır. Bu sorunu çözmek için 3 boyutlu biyolojik yazıcı kullanılarak üretilen bir iskelet üzerinde hücre büyütme çalışmaları yapılıyor. Bu tür çalışmalarda temel sorun kollajen, laminin, elastin, fibronektin ve büyüme faktörlerinden oluşan hücresel bir ortamın gerekliliğidir.
Organik teknolojinin gelişimi ve çeşitli alanlarda insan organik organizmalarının üretimi; Kök hücre biyolojisi, gelişim biyolojisi, matris biyolojisi, sistem biyolojisi, biyomühendislik, malzeme bilimi, biyoistatistik ve biyoinformatik gibi çeşitli bilim dallarından bilgi ve teknolojinin sentezini gerektirir. Bu çalışmalar artık özel kurum ve kuruluşlar tarafından desteklenmektedir. Bilimsel çalışmalarla mevcut sorunlar aşıldığında önümüzdeki yıllarda organoid teknolojisinin toksisite ve ilaç testlerinde kullanılması mümkün olacak ve bu teknoloji standart transplantasyon uygulamalarının yerini alacaktır.
Kaynak:
1) LouveLeung. Biyomedikal araştırma ve uygulamalar için yeni nesil organizmalar. doi: 10.1016/j.biotechadv.2017.10.005
yazar: Ayka Olkay
Diğer gönderilerimize göz at
[wpcin-random-posts]